ELECTROLYSE : LOI DE FARADAY
ETUDE QUALITATIVE DE L’ELECTROLYSE
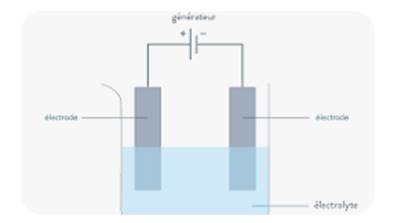
Expérience
On
relie aux bornes d’un générateur électrique deux morceaux de charbon appelées électrodes :
-L’électrode
reliée à la borne positive est l’anode,
-L’électrode
reliée à la borne négative est la cathode.
Les
deux électrodes plongent dans une cuve contenant une solution conductrice
appelée électrolyte.
Cas
de l’acide chlorhydrique diluée :
En
solution, on a : HCl → H+ + Cl-
NB :En solution aqueuse,
l’ion H+ se combine à une molécule d’eau pour donner l’ion H3O+
Lorsqu’on ferme le circuit on constate :
- le courant circule dans le circuit (de
l’anode vers la cathode).
-il y a un dégagement du dichlore à l’anode et
du dihydrogène à la cathode.
Le
passage du courant électriques un électrolyte s’accompagne d’un ensemble de
réactions chimiques, localisées à la surface de contact des électrodes et de
l’électrolyte, auquel on donne le nom d’électrolyse.
Interprétation
Au cours de
l’électrolyse, les ions négatifs se déplacent vers l’anode et les ions positifs
vers la cathode.
-
A
l’anode, les ions chlorures cl- se déchargent : chacun d’eux
cède à l’anode son électron excédentaire se transformant ainsi en atome de
chlore, puis ces atomes s’unissent deux a deux pour former des molécules
diatomique Cl2 du chlore gazeux dont on observe le dégagement sur
l’anode.
Cet ensemble de
transformation constitue une réaction d’électrode que l’on résume par
l’équation :
2Cl- →
Cl2 +2e
-
A
la cathode se produit la décharge des ions H+. Chacun d’eux fixe un
électron cédé par la cathode pour se transformer en atome d’hydrogène. Ces
atomes s’unissent deux à deux pour former les molécules diatomiques H2
de l’hydrogène gazeux libérés à la cathode.
La réaction d’électrode
se résume ici par l’équation chimique :
2H+
+2e→H2
En un temps donné,
l’anode reçoit autant d’électrons du fait de la décharge des ions chlorures que
la cathode en cède aux ions hydrogènes pour les décharger.
Le courant électrique
est constitué par les déplacements simultanés et en sens inverses des ions
positifs vers la cathode et des ions négatifs vers l’anode.
NB : les électrodes de charbon ne
participent pas aux réactions, on dit qu’ils sont inattaquables.
Exemples d’électrolyses complexes
Dans
la plupart des cas, les réactions d’électrodes sont plus complexes : en
particulier, l’eau de la solution ou encore le métal des électrodes peuvent
participer à ces réactions. D’autre part, la décharge d’un ion formé de
plusieurs atomes (comme HO- et NH4+) peut s’accompagner
d’une décomposition de cet ion.
Electrolyse d’une solution aqueuse de chlorure de sodium (Na+ +
Cl-) entre électrodes de charbon
-A l’anode, les ions
chlorure se déchargent et donne du chlore qui se dégage :
2Cl- →Cl2 +2e
-A la cathode, deux individus nouveaux
apparaissent : l’hydrogène qui se dégage et les ions hydroxydes HO-.
Les ions Na+ qui existaient
dans la solution avant l’électrolyse, s’y retrouvent après et en même
nombre. Si l’on compare l’état final à l’état initial du compartiment
cathodique, on constate que les molécules d’hydrogène et les ions HO-
ne peuvent provenir que de la décomposition de molécules d’eau.
2H2O + 2e →2HO- +H2
Application :
fabrication
industrielle de la soude
Electrolyse
d’une solution aqueuse de soude entre électrodes de Nikel
-
A
l’anode les ions hydroxydes HO- se déchargent et il se forme de
l’eau et de l’oxygène :
2HO- →H2O
+ O2 + 2e
-
A
la cathode, les molécules d’eau sont décomposées :
2H2O + 2e →2HO- + H2
L’électrolyse
produit juste la décomposition de l’eau :
H2O→H2 +1/2 O2
Electrolyse d’une solution de sulfate
de cuivre avec anode en cuivre (électrolyse dite « à anode soluble »)
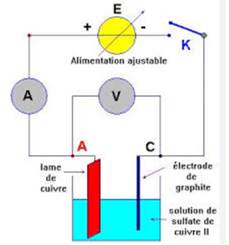
La solution contient des ions cuivriques Cu2+ et
des ions sulfates SO42- dispersées parmi les molécules
d’eau.
-A la cathode, les ions cuivriques se déchargent :
Cu2+ + 2e →Cu
Du cuivre métallique se dépose sur la cathode.
- A
l’anode, les ions sulfates ne se déchargent pas, mais
leur accumulation au voisinage de l’électrode facilite l’ionisation d’atomes de
cuivre de l’anode :
Cu→Cu2+ + 2e
Cette réaction d’électrode fait passer progressivement
du cuivre de l’anode dans la solution, d’où le nom « d’électrolyse a anode
soluble » donné à ce type d’électrolyse.
Applications :
-affinage électrolytique des métaux :
diminution des impuretés sur le cuivre afin d’obtenir du cuivre électrolytique
plus pur…
-dépôt électrolytiques des métaux :
revêtements métalliques, dépôt de chrome sur les pare-chocs des véhicules…
ETUDE QUANTITATIVE DE
L’ELECTROLYSE : LOI DE FARADAY
Loi de FARADAY
Le volume de gaz dégagé ou la masse du métal
déposé à
la cathode d’un électrolyseur est proportionnelle à la quantité d’électricité
qui a traversé toutes les sections du circuit pendant l’électrolyse.
![]()
Q=It : quantité
d’électricité
x :
nombre d’électrons échangés (valence)
F : le faraday (1F=96500
C)
En
prenant ![]() ou
ou ![]() : nombre de moles de matière formée (mol)
: nombre de moles de matière formée (mol)
Vm : volume molaire
![]()
La
quantité de matière formée aux électrodes d’un électrolyseur est
proportionnelle à la quantité d’électricité qui traverse l’électrolyseur et
inversement proportionnelle au faraday.
Application :
1.Calculons la masse déposée à la cathode d’un
électrolyseur a sulfate de cuivre traverse par un courant de 2 A pendant 5 mn.
Cu :64 1F=96500 C
Cu→Cu2+ +2e donc x=2
![]()
2.Dans une électrolyse d’une solution de soude on veut obtenir
en 5 minutes un dégagement de 100 cm3 on veut obtenir en 5 mn un
dégagement de 100 cm3 d’hydrogène (volume ramené aux conditions
normales).
Quelle doit être l’intensité du courant (suppose constant) qui
traverse l’électrolyseur ?
2HO- →H2O + O2
+ 2e
x=2
![]()
EXERCICES
EXERCICE I:
1-Quelles
sont les réactions d’électrodes qui interviennent dans l’électrolyse d’une
solution d’acide chlorhydrique entre électrodes inattaquables en charbon ?
En déduire les produits recueillis aux électrodes.
2-Meme
question avec une solution aqueuse de sulfate de cuivre avec électrodes
inattaquables en platine sachant que l’eau participe a cette reaction.
3-En
deduire les réactions d’électrodes qui interviennent dans l’électrolyse d’une
solution d’acide sulfurique entre électrodes inattaquables en platine, les
produits recueillis aux électrodes et le bilan de l’électrolyse.
EXERCICE
II:
1-Pendant
combien de temps faut-il faire passer un courant d’intensité I=0,537 A dans un
électrolyseur a solution aqueuse de soude pour obtenir un volume gazeux total
(à la cathode et a l’anode) de 150cm3(conditions normales) ?
2-
On veut recouvrir d’un dépôt électrolytique de cuivre une lame de 100 cm2
de surface ; sachant que le courant qui produit l’électrolyse a une
intensité constante de 5 A.Calculer
le temps pendant lequel il devra passer pour produire un dépôt de 0,1 mm
d’épaisseur ?
Cu=64 ;
ρcuivre=8,8 g/cm3
3-Deux
électrolyseurs en série contiennent respectivement des solutions aqueuses de
sulfate ferreux (Fe2++SO42-) et de chlorure
ferrique (Fe3+ + 3 Cl-) ; sachant qu’on a obtenu par
électrolyse 12 g de fer a la cathode du premier, qu’a-t-on obtenu à celle du
second ?
EXERCICE III:
On monte en série aux bornes d’un générateur deux
électrolyseurs. Le premier contient une solution aqueuse de HCl
avec électrodes de graphite et l’autre une solution de AgNO3 entre
électrodes d’argent.
1-Ecrire
les équations aux deux cathodes
2-On
a obtenu, entre la fermeture et l’ouverture du circuit 116 cm3 d’hydrogène a la
cathode de l’électrolyseur a solution chlorhydrique (conditions normales),
calculer :
2.1-la
quantité d’électricité qui a traversé le circuit.
2.2-la
durée de l’expérience, sachant que l’ampèremètre marquait 2 A.
2.3-La
masse d’argent déposée a la cathode de l’autre
électrolyseur.
Ag=108
CORRIGES
EXERCICE I:
1-
Anode : 2Cl- → Cl2 +2e
Cathode : 2H+ +2e→H2 // ou 2H3O+ 2e→H2 +2H2O
On recueille un dégagement du dichlore a l’anode et du dihydrogène a
la cathode.
2-
Cathode : Cu2+ + 2e →Cu
Anode: 2H20→O2+4H+
+2e //ou 3H2O→1/2O2
+2H3O+ +2e
Le cuivre se dépose à la cathode et le dioxygène se dégage à
l’anode.
NB : les molécules d’oxygène et les ions hydrogènes proviennent
de la décomposition de l’eau’ les ions H+ se mélangent aux ions SO42-
pour former une solution d’acide sulfurique.
3-.
Cathode: 2H+ + 2e→H2 // ou 2H3O+
2e→H2 +2H2O
Anode: H2O→1/2O2 + 2H+ + 2e //ou 3H2O→1/2O2
+2H3O+ +2e
Dégagement du dihydrogène a la cathode et d’un volume 2 fois moindre
de dioxygène a l’anode ;
Le bilan est la décomposition de l’eau. H2O→1/2O2 + H2
EXERCICE II:
1-Pendant combien de temps faut-il faire passer un courant
d’intensité I=0,537 A dans un électrolyseur a solution aqueuse de soude pour
obtenir un volume gazeux total (à la cathode et a l’anode) de 150cm3(conditions
normales) ?
H2O→1/2O2 + H2
Il y a une mole de H2 pour une demie mole de O2 or
une mole de gaz occupe 22400 cm3.
Il y a 2 volumes de H2 pour un volume de O2 , soit VH2=100 cm3 et VO2=50
cm3
![]() Soit 26mn 44s
Soit 26mn 44s
![]()
2- On veut recouvrir d’un dépôt électrolytique de cuivre une lame de
100 cm3 de surface ; sachant que le courant qui produit l’électrolyse a
une intensité constante de 5 A. Calculer le temps pendant lequel il devra
passer pour produire un dépôt de 0,1 mm d’épaisseur ?
Cu=64 ; ρcuivre=8,8 g/cm3
s=πr2
V=se=m/ρ
=>m=ρse=8,8x100x0,01=8,8g
![]() soit 1 h 28mn 28s
soit 1 h 28mn 28s
2-Deux électrolyseurs en série contiennent respectivement des
solutions aqueuses de sulfate ferreux (Fe2++SO42-)
et de chlorure ferrique (Fe2+ + 3 Cl-) ; sachant
qu’on a obtenu par électrolyse 12 g de fer a la cathode du premier, qu’a-t-on
obtenu à celle du second ?
Premier électrolyseur :
![]() (1)
(1)
Deuxième électrolyseur
![]() (2)
(2)
En divisant (2) par (1), on a : m’=mx/x’=12x2/3=8 g de fer
EXERCICE III:
1-Ecrire les équations aux deux cathodes
2H+ +2e→H2
Ag+ +
e→Ag
2-
2.1-la quantité d’électricité qui a traversé le circuit.
![]()
2.2-
t=Q/I=1000/2=500 s soit 8mn 20s.
2.3-
![]()