CLASSIFICATION
ELECTROCHIMIQUE
Généralités :
Définition : On appelle acide,
tout corps capable de céder un proton H+ en solution (selon
Bronsted).
Dans une solution aqueuse (dont le solvant est l’eau), H+
s’associe à une molécule d’eau pour former l’ion hydronium H3O+
selon l’équation.
H+ + H20 → H3O+
- Base selon Bronsted
On appelle base toute
substance capable de capter un proton H+.
Remarque :
Dans
toute solution aqueuse, on retrouve les ions hydronium H3O+
et les ions hydroxydes OH-. La solution est acide si elle contient
plus d’ions hydroniums que d’ions hydroxydes.
[H3O+] >
[HO-]
On mesure l’acidité d’une solution
en calculant son pH (potentiel hydrogène)
[H3O+]
= 10-pH
Le pH de l’eau pure est 7
pH < 7 →solution acide
pH = 7 → solution neutre
pH >7 →
solution basique
Exemple : Acide chlorhydrique :
HCl+ H20
→ H3O+ + Cl-
Action des solutions acide sur les métaux
H2
Expérience : Dans 5 tubes à essais,
introduisons un peu de poudre d’Al dans le 1er, de la limaille de
fer dans le 2e, de la grenaille de zinc dans le 3e, un
morceau d’argent dans le 4e et de la tournure de cuivre dans le 5e
→Ajoutons dans chaque
tube 2 ml de solution de HCl
Cu


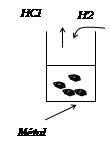



Observations : Dans les tubes
contenant l’Ag et le Cu, on n’observe rien par contre dans les 3 autres, on
observe des bulles de gaz suivies d’une effervescence. Si on approche une
allumette enflammée à l’extrémité des tubes à dégagement, il y a détonation :
c’est du dihydrogène.
Prélevons environ 1 ml de solution
contenue dans chacun des 3 tubes et ajoutons-y du NaOH
→Dans le tube contenant Al,
on obtient un précipité blanc qui se dissout dans un excès de NaOH, mais
insensible dans l’ammoniac. Ce précipité est de l’hydroxyde d’aluminium Al(OH)3, il met en évidence la présence des ions
Al3+
→Dans le tube contenant
le fer, il se forme un précipité vert d’hydroxyde de fer II : Fe(OH)2, il y a des ions Fe2+.dans la
solution.
→Dans le tube contenant
le Zinc ; il se forme un précipité blanc qui se dissout dans un excès
d’hydroxyde de sodium et dans l’ammoniac Il y a des ions Zn++.dans
la solution.
La réaction entre le fer et l’HCl est une
réaction d’oxydo-réduction
L’ion
H3O+ attaque le Fe, Al et Zn avec dégagement du
dihydrogène H2 et formation des ions Fe2+, Al3+
et Zn2+ .
C’est un oxydant ; son réducteur conjugué est le dihydrogène H2.
La demi-équation électronique du couple H3O+/H2
s’écrit
2H3O+
+ 2e ⇆ H2
+ 2H2O
Interprétation: Dans les tubes 1,2 et
3, le métal est transformé en ions métalliques en cédant des électrons
Al →Al3+ + 3e
Fe →Fe 2+ + 2e
Zn →Zn
2+ + 2e
Les ions hydroniums de la solution
acide ont capté des électrons et il y a eu dégagement du dihydrogène
2H3O+ + 2è ⇆ H2 + 2H2O
Equations- bilan.
Al
(2 x) Al →Al3+
+ 3è
![]() (3 x) 2H3O+
+ 2è → H2 + 2H2O
(3 x) 2H3O+
+ 2è → H2 + 2H2O
2Al +
6H3O+ →3Al+ + 3H2
+ 6H2O
Fer
Fe →Fe2+ + 2è
![]() 2H3O+ + 2è →2H2 + 2H2O
2H3O+ + 2è →2H2 + 2H2O
Fe + 2H3O+ → Fe2++
2H2 + 2H2O
Zn
Zn → Zn2+ + 2è
![]() 2H3O+ + 2è →2H2 + 2H2O
2H3O+ + 2è →2H2 + 2H2O
Zn + 2H3O+ → Zn2++
2H2 + 2H2O
Conclusion: HCl ou H2SO4
dilué attaque les métaux tels que Fe, Al et Zn avec dégagement du dihydrogène
et formation d’ions métalliques. Au cours de la réaction il y a transfert
d’électron du métal aux ions H3O+ de l’acide. Mais ces deux acides
sont sans actions sur les métaux tels que le Cu et Ag.
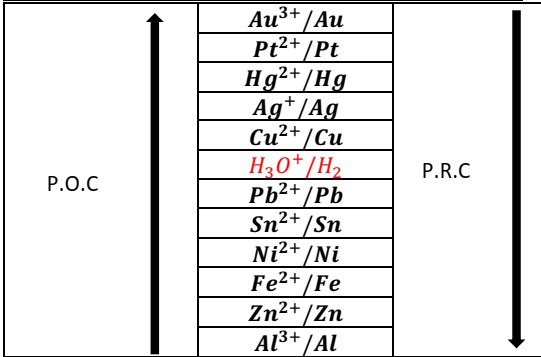
Classification
qualitative des couples oxydant-réducteur
Classification
qualitative des
couples Mn+/M
-
Réaction entre le métal Zinc et Fe2+ : Le métal Zn
attaque les ions Fe2+
Fe2+
+ Zn →Fe + Zn2+
La Réaction entre le
métal Fe et les ions Cu2+ : Le métal Fe attaque les ions Cu2+
Cu2+ + Fe →Cu+
Fe2+
L’inverse
est impossible
Ces résultats
permettent de classer
- Les oxydants : par
pouvoir oxydant croissant (de gauche à droite)
Zn2+ Fe2+ Cu2+
- Les réducteurs : par
pouvoir réducteur croissant (de gauche à droite)
Cu Fe Zn
![]()

REMARQUE : Plus l’oxydant est
fort, plus son réducteur conjugué est faible
Place
du couple H3O+/H2
Les ions H3O+
attaquent le fer, mais pas le cuivre, donc H3O+ est plus
oxydant que Fe2+ et moins oxydant que Cu2+. De plus H3O+
attaque le plomb donc H3O+ est plus oxydant que Pb2+
Donc ce couple est placé après le couple Cu2+/Cu
et avant le couple Pb2+/Pb.
Intérêt de la
classification
Quand
deux couples Ox/Red sont mis en présence, le sens naturel de la réaction qui se
produit est celui des formes les plus fortes vers les formes les plus faibles.
Une
réaction spontanée peut donc être traduite sous la forme :
Oxydant
fort + réducteur fort → Oxydant faible + réducteur faible.
La règle du
« Gamma » décrit dans le sens de la flèche, est une règle simple qui permet
de retrouver ce résultat.
·
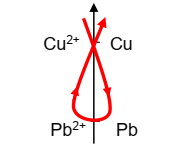
La classification
qualitative permet :
- De prévoir si une
réaction oxydoréduction est possible entre un oxydant et un réducteur donné.
- D’écrire l’équation
bilan d’une réaction oxydoréduction.
EXERCICES
EXERCICE I :
1.
En utilisant le tableau de classification électrochimique, prévoir la réaction
naturelle qui a lieu entre les couples :
a) H3O+/H2 et
Ag+/Ag
b) H3O+/H2 et
Pb+/Pb
2.
Ecrire dans chaque cas son équation bilan.
3.
Peut-on alors prévoir si ces deux métaux vont réagir avec une solution diluée
et froide d’acide sulfurique ?
EXERCICE II :
Les
ions nickel Ni2+ réagissent en solution avec les ions hydroxydes OH-
d’une solution de soude pour donner un précipité vert d’oxyde de nickel (II) Ni(OH)2.
1.
Le nickel métallique réagit avec les ions hydrogènes pour donner du dihydrogène
et des ions nickel (II). Qu’observe-t-on au cours de cette réaction ?
2.
Décrire soigneusement les expériences à réaliser pour identifier les produits
de cette réaction.
EXERCICE III :
On verse une masse de 1g de limaille de Fer
dans un erlen mayer contenant 250ml d’une solution diluée et froide d’acide
sulfurique telle que la concentration en ions hydrogène soit initialement égale à
0,20mol/l.
1.
Ecrire l’équation bilan de la réaction qui se produit.
2.
Quel est le volume du dihydrogène dégagé ?
3.
Quelles sont les concentrations finales en ions hydrogènes et en ions fer(II).
EXERCICE IV :
On
plonge une lame de nickel dans un bécher contenant 250ml de solution d’acide
chlorhydrique de concentration 0,1mol/l. On laisse la réaction se dérouler
complètement, puis on retire la lame de nickel et on détermine la concentration
des ions hydrogènes restants : 2,50.10-3 mol/l
1.
Sachant que le pouvoir réducteur du nickel est supérieur à celui du
dihydrogène, écrire l’équation bilan de la réaction qui se produit.
2.
Déterminer le volume d’hydrogène dégagé au cours de cette expérience
(Vm=22,4l).
3.
Détermine la masse de nickel qui a réagi.
EXERCICE V :
On traite un
échantillon d’aluminium de masse m=1,35g par une solution d’acide chlorhydrique
de concentration c=0,2 mol/l.
1-
Définir
couple oxydant-réducteur.
2-
Ecrire
les demi-équations électroniques correspondantes.
-En déduire l’équation
bilan de la réaction ; Quel est l’oxydant le plus fort ? Quel est le
réducteur le plus fort ?
3-Déterminer le volume minimal de la solution d’acide chlorhydrique à
utiliser pour obtenir la disparition complète de l’échantillon d’aluminium.
4-Quel est le volume de dihydrogène
dégagé au cours de cette réaction ?
5-Déterminer la concentration des ions
Al3+ dans la solution obtenue.
6-Calculer la masse du chlorure
d’aluminium obtenue après avoir écrit l’équation globale de la réaction.
Données : Vm=22,4
l ; masses molaires atomiques (g/mol) Al :27 ; Cl :35,5.
EXERCICE VI :
1- On donne les espèces chimiques
suivantes : Ni ; Sn2+ ; Mg ; Sn ; Mg2+ ; Ni2+
1-1 Former 3 couples redox possibles à partir de ces
espèces.
1-2 Au cours d’une séance de travaux pratiques, les élèves
ont constaté que l’ion magnésium Mg2+ est sans action sur les métaux
nickel (Ni) et étain (Sn) et que l’ion nickel (Ni2+) est sans action
sur l’étain métallique.
1-2-1 quel est le réducteur le plus
fort dans cette expérience ?
1-2-2 Classer les couples redox
intervenant dans cette expérience par pouvoir réducteur décroissant.
1-2-3 Les valeurs des potentiels
standards redox des couples intervenant dans cette expérience sont : -2,37
V ; -0,14 V et -0,23 V Affecter à
chaque couple la valeur de son potentiel standard redox.
CORRIGES
EXERCICE I :
1.
a) L’oxydant le plus fort (Ag+)
va réagir avec le réducteur le plus fort(H2)
b) L’oxydant le plus fort (H+
va réagir avec le réducteur le plus fort (Pb)
2. a) H2 →2H+. +2e
Ag+ + e → Ag
Equation bilan : 2Ag+ +H2 →2Ag +2H+
b) Pb → Pb2+. +2e
2H+ + 2e→H2
Equation bilan :2H+ + Pb →H2 + Pb2+
3.
La solution diluée et froide d’acide
sulfurique va réagir uniquement avec le plomb. // L’oxydant le plus fort
(H+) va réagir avec le réducteur le plus fort (Pb).
EXERCICE II :
1. On observe des bulles dans la
solution (dégagement du dihydrogène) et la solution devient verte.
2. Identification :
Gaz : On recueille le gaz grâce
à un tube à essai dont l’ouverture fait face au récipient contenant la
solution. Ce gaz détonne à l’approche une allumette enflammée : C’est du
dihydrogène.
Ions : En ajoutant de la soude à
la solution, il se forme un précipité vert de Ni(OH)2 :
Ce sont les ions Ni++.
EXERCICE III :
1. Fe + 2H+ →Fe2+ +
H2
1mol
2 mol. 1mol. 1mol
2. n(H2) = n(Fe)
Or n(Fe)=m(Fe)/M(Fe)=1/56=1,8.10-2
mol
n(H+)=cV=0,2x0,25=5.10-4 mol
Dans les conditions
stœchiométriques : n(H+)=2n(Fe)
Dans les conditions de
l’expérience
N(H+)/n(Fe)=
2,77>2 =>
les ions H+ sont en excès, le fer ayant totalement réagit.
n(H2)=V(H2)/Vm =>V(H2)=n(H2)xVm=1,8x10-2 x
22,4=0,40l.
3. Calcul de concentrations finales en ions Fer(II).
![]() =
=![]() =
=![]() =
=![]() .
.
Calcul de concentrations finales en ions hydrogène.
n(H+)r=
2n(Fe2+)=2x1,8.10-2=3,6.10-2
n(H+)f=
n(H+)i - n(H+)r =510-4 -3,6.10-2=1,4.10-2
mol
[H+]f =1,4.10-2/0,25=0,056mol/l.
EXERCICE
IV :
1.
Ni + 2H+
→ Ni2+. + H2
1mol 2mol 1mol
1mol
2. ni(H+) =[H+]i.V=0,25 x
0,10=0,025 mol.
La quantité de H+ en solution est :
nf(H+) =[H+].V=2,5.10-3 x0,25=6,25.10-4 mol.
La quantité de H+ ayant réagi est :
nr(H+)=ni(H+)-nf(H+)=2,025-6,25,10-4=0,024mol
D’après l’équation n(H2) = n(H+)/2
donc
![]() =>
=>![]()
3. Masse de nickel qui a réagi.
D’après l’équation n(Ni)=nr(H2)
<=> m(Ni)/M(Ni)nr(H2)
=>
m(Ni) = nr(H2) x
M(Ni)=0,024375 x58,7= 1,53g.
EXERCICE
VI :
1-Sn++/Sn ;Mg++/Mg
et Ni++/Ni
2-
2-1 le réducteur le plus fort dans cette
expérience est Mg.
2-2 Mg++/Mg Ni++/Ni Sn++/Sn →
2-3 Les valeurs des potentiels standard
redox des couples intervenant dans cette expérience sont : -2,37 V ;
-0,14 V et
-0,23 V. Affecter à chaque
couple la valeur de son potentiel standard redox.
E°( Mg++/Mg)=-2,37 V ; E°( Ni++/Ni)=-0,23
V ; E°( Sn++/Sn )=-0,14 V
3-a)Non, il n’y a
pas variation du nombre d’oxydation des espèces mis en jeu dans cette réaction
b) Oui, il y a variation du nombre
d’oxydation des espèces mis jeu dans cette réaction.
Réducteur :CO
Oxydant :Fe2O3
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez un commentaire