GENERALITES SUR L’OXYDOREDUCTION
NOTION DE COUPLE
OXYDANT-REDUCTEUR
I- GENERALITES SUR L’OXYDOREDUCTION
Les métaux et
leurs ions
Les ions
Un ion est un atome (ou un groupe d’atomes) qui perdu (ou gagné) un
(ou plusieurs) électrons. Lorsque l’atome a perdu des électrons, il devient un
ion positif ou cation ;
lorsqu’il a gagné des électrons, il devient un ion négatif ou anion.
Les ions
monoatomiques proviennent d’un seul atome (Na+, Ca2+).
Les ions polyatomiques sont formés à
partir de plusieurs atomes (NH4+, SO42-)
Les éléments dont les atomes ont tendance à
perdre des électrons et donner des ions positifs sont dits électropositifs. Les éléments dont les atomes ont tendance à gagner
des électrons et donner des ions négatifs sont dits électronégatifs.
Les métaux sont des corps qui ont la
propriété de donner des ions positifs ou cations.
"
Les
métaux alcalins (colonne I du tableau de classification périodique des
éléments) donnent des ions monovalents (K+, Na+,)
" Les alcalino-terreux
(colonne II) donnent des ions divalents (Ca2+, Hg2+)
"
Les
métaux de transition donnent à chaque métal plusieurs sortes d’ions (Fe3+,
Fe2+)
Les ions métalliques en solution aqueuse.
Une solution est un
mélange homogène d’une substance appelée soluté,
avec une autre substance liquide appelée solvant.
La solution est dite aqueuse si le
solvant est l’eau.
En solution aqueuse, tous les ions sont
hydratés et dispersés.
On appelle concentration molaire d’une solution
la quantité en mole de soluté dissous dans un litre de solution :
![]()
n: nombre de moles du
soluté (mol)
V : Volume de la
solution (l)
C : concentration
molaire (mol/l)
Certains
cations métalliques donnent une couleur caractéristique aux solutions qui les
renferment. On a ainsi :
- L’ion ferreux
(II) (Fe2+) donne une couleur vert-pâle en solution aqueuse.
- L’ion
cuivrique (Cu2+) donne une couleur bleue en solution aqueuse.
- L’ion ferrique
(III) (Fe3+) donne une couleur rouille en solution aqueuse.
- L’ion cobalt (Co2+)
donne couleur rose en solution aqueuse.
Il y a également des
cations qui peuvent être reconnus par la formation de précipité
caractéristiques en présence d’une solution de NaOH
et leur éventuelle disparition par un excès de réactif
Exemple :
Zn2+ :
précipité blanc d’hydroxyde de zinc (Zn(OH)2 )
Al3+ :
précipité blanc d’hydroxyde d’Aluminium (Al (OH)3) qui se dissout
dans un excès de réactif.
Fe2+ :
précipité vert d’hydroxyde de Fer II (Fe (OH)2)
Fe3+ :
précipité rouille d’hydroxyde de Fer III (Fe (OH)3)
Une solution aqueuse ionique renferme
nécessairement les deux espèces d’ions : les ions positifs et les ions
négatifs. Toute solution électriquement neutre contient autant de charges
positives que de charges négatives.
Réaction
entre un ion métallique (Mn+) et un métal (M)
Cas de Cu2+ et le fer
Expérience :
Couleur
Verte

![]() Fe
Fe
![]()

On plonge du fer dans
une solution de Sulfate de cuivre. La couleur bleue indique la présence des
ions Cu2+. Après un certain temps on observe la disparition de la couleur
bleue au profit de la coloration verte. En plus, si on prélève une partie de la
solution finale à laquelle ou ajoute de la soude (NaOH),
on obtient un précipité vert et un dépôt rougeâtre.
Interprétation :
Le fer à réagit avec les ions cuivriques de la
solution. Il y a eu consommation des Cu2+ qui ont été remplacé par
des ions Fe2+.
Au
contact de la solution, le fer a cédé deux électrons pour devenir l’ion Fe2+
Fe → Fe2+ + 2e
Les
ions Cu2+ initialement dans la solution ont capté les deux électrons
pour devenir du cuivre métallique (rougeâtre)
Cu2+ + 2è → Cu
Il
y a donc eu consommation des ions Cu2+ qui ont été finalement
remplacé par les ions Fe2+ d’où la (couleur verte)
Cas de l’ion Ag+ et de cuivre
Fil
de cuivre
Expérience :
![]()

On introduit dans une solution
de Sulfate d’Argent un fil de cuivre. La solution initiale est incolore.
Observation : la solution prend
progressivement la teinte bleue et la lame de cuivre se recouvre d’un dépôt
cristallin blanc brillant.
Interprétation :
Au contact de la solution, le cuivre libère 2
électrons selon la demi-équation
Cu → Cu2+ + 2e
Les ions Ag+ présents dans la solution captent
chacun un électron et l’argent se dépose.
Ag+ + e → Ag
Il y a eu un transfert d’électron entre le cuivre métallique et les ions
Ag+ de la solution.
Définitions
On appelle réaction d’oxydo-réduction, une réaction au
cours de laquelle il y a transfert d’électrons.
L’oxydation : est une perte
d’élection
Ex : Cu → Cu2+ + 2e
La réduction : est un gain
d’élection
Ex : Ag+ + e → Ag
Un oxydant est une substance chimique capable
de capter un ou plusieurs électrons : Exemple :
Ag+
Un réducteur est une substance chimique capable
de céder un ou plusieurs électrons. Exemple : Cu
II-COUPLE OXYDANT-REDUCTEUR
·
Réaction entre le cuivre et l’ion argent
Au cours de la réaction entre le cuivre (Cu) et
l’argent (Ag), le cuivre cède des électrons aux ions argent (Ag+).
Il est oxydé à l’état d’ions cuivrique (Cu2+), selon la demi-
équation :
Cu → Cu2+ + 2e
·
Réaction entre le
cuivre et le Fer
Au cours de la réaction
entre le fer ou le zinc avec les ions cuivriques Cu2+, ils sont
réduits à l’état de cuivre métallique Cu, selon la demi-équation
électronique :
Cu2+ + 2è → Cu
Dans la
première expérience, le cuivre métallique est oxydé en ions Cu2+.
Dans la deuxième
expérience, ce sont les ions Cu2+ qui sont réduits en cuivre
métallique Cu
L’élément cuivre se
présente donc, soit comme un oxydant Cu2+, soit comme un réducteur Cu .A ces transformations correspondent les 2
demi-équations :
Cu2+ + 2è → Cu
Cu → Cu2+ + 2e
On traduit ces faits
par une double flèche dans l’écriture de la demi-équation électronique :
Cu2+ + 2è ⇆ Cu
Cu2+
et Cu sont deux formes conjuguées d’un même élément. Ces deux espèces
constituent un couple : le couple oxydant-réducteur, notée Cu2+/Cu.
En général, à tout métal M
correspond un cation naturel Mn+. Ces deux espèces forment le couple
Mn+/M
Exemples : Au3+/Au ; Ag+/Ag,
Pb2+/Pb, Fe2+/Fe, Al3+/Al
Couple redox : Ox/Red
Demi-équation : Mn+ + ne ⇆ M
Equation-bilan
d’une réaction d’oxydoréduction
Cas de Fe2+ et Zn
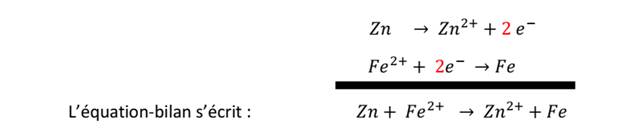
Réaction
entre le cuivre et l’ion Argent
L’équation-bilan est obtenu après
multiplication des coefficients par les nombres écrits entre parenthèses
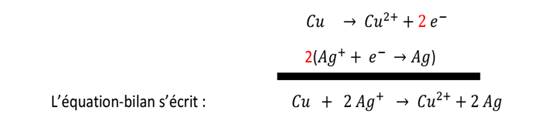 //on multiplie la 2eme équation par 2 pour éliminer 2e
et avoir une équation bilan équilibrée
//on multiplie la 2eme équation par 2 pour éliminer 2e
et avoir une équation bilan équilibrée
Réaction entre le Fer et l’ion cuivrique
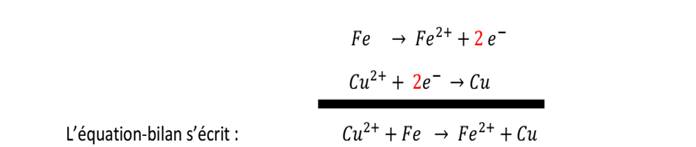
EXERCICES
EXERCICE
I :
1.Au cours d’une réaction entre le cuivre et les ions argent, le cuivre a
perdu deux électrons pour devenir l’ion cuivrique. De l’autre cote, l’ion
argent a capte un électron pour devenir de l’argent métallique.
1.1 Quel est, au cours de cette réaction l’oxydant ? le
réducteur ?
1.2 Ecrire les demi-équations électroniques traduisant l’oxydation et la
réduction.
1.3 Ecrire et équilibrer l‘équation bilan de cette réaction.
2. Une réaction d’oxydoréduction se traduit par l’équation bilan non
équilibrée :
Au3+ +Zn → Au +Zn2+
2.1
Ecrire les demi-équations électroniques traduisant l’oxydation et la réduction
2.2 Quel
est l’oxydant ? le réducteur ?
2.3
Equilibrer l’équation bilan.
3. Ecrire
l’équation-bilan de la réaction entre l’aluminium Al et les ions Ag2+.
Quel est l’oxydant
Quel est le réducteur
4.
L’équation-bilan d’une
réaction s’écrit :
Zn + Hg2+ → Zn2+ + Hg
a)
Ecrire
les demi-équations électroniques traduisant l’oxydant et la réduction
b)
Quel
est l’oxydant
c)
Quel
est le réducteur
EXERCICE
II :
Une lame de zinc plongée dans 100 cm3 d’une solution de
sulfate de cuivre de concentration 0,2mol/l est laissée jusqu’à la disparition
complète de la couleur bleue.
1.
Qu’indique la couleur bleue ?
2.
Pourquoi elle disparait ?
3.
Quelle est la masse du cuivre déposée.
On donne : Cu :63,5
EXERCICE
III :
L’acide chlorhydrique attaque le magnésium avec un
dégagement de dihydrogène.
1.Ecrire l’équation bilan de cette réaction.
2.On place 5g de magnésium dans 20 cm3
d’acide chlorhydrique de concentration 0,1 mol/l.
2.1 Les
réactifs sont -ils dans des proportions stœchiométriques ?
2.2 Calculer
le volume de dihydrogène dégagé dans les conditions ou le volume molaire est 25
l.
EXERCICE IV :
Une lame de
cuivre baigne dans 100 cm3 d‘une solution aqueuse de nitrate
d’argent (Ag+ +NO3-) de concentration 0,1 mol/l. On
constate qu’elle se recouvre d’argent.
1.Interpreter ce résultat.
2.Quelle masse maximale d’argent peut-on
recueillir ?
3.Quelle est alors la perte de masse subie par la
lame de cuivre ?
EXERCICE V :
On introduit la
poudre de zinc dans 200 cm3 d’une solution aqueuse de sulfate de
cuivre de concentration 0,1 mol/l.
1.Calculer la masse de zinc nécessaire a la réduction de tous les ions cu2+.
2.Calculer, dans ce cas la masse du cuivre forme
ainsi que la concentration des ions zn2+.
3.Verifier l’électroneutralité de la solution.
EXERCICE VI :
On plonge dans un
bécher contenant une solution aqueuse de sulfate de cuivre un clou en fer
préalablement décapée. On constate au bout d’un certain temps que la solution
initialement bleue est devenue verdâtre pendant que le clou s’est recouvert
d’un dépôt rougeâtre.
a)
A
quoi sont dus la coloration verdâtre de la solution et le dépôt rougeâtre sur
le clou en fer ?
b)
Comment
appelle-t-on la réaction qui a eu lieu ?
c)
Ecrire
les demi-équations électroniques et en déduire l’équation- bilan de cette
transformation.
d)
Recopier
et compléter les phrases suivantes :
Dans cette transformation, le fer a…………………….deux électrons ; le fer est un………………..,
il a subi une……………………. L’ion cuivrique a…………………………..deux
électrons ;l’ion cuivrique est un ………………….., il a subi une …………………………..
EXERCICE VII :
On
veut étudier l’action des ions métalliques sur un métal dans une solution
aqueuse. Pour cela, on dispose de la poudre métallique, de la poudre d’argent
métallique, une solution molaire de sulfate de cuivre et une solution molaire
de nitrate d’argent. Pour savoir de l’argent ou du cuivre métallique quel est
le réducteur le plus fort, on fait deux expériences :
Expérience
1. On verse la poudre d’argent dans la solution de sulfate de cuivre ; on
n’observe rien
Expérience
2. On verse de la poudre de cuivre la solution de nitrate d’argent ; après
un certain temps on observe un changement de coloration de la solution.
1)
Définir les termes : solution molaire, réducteur
2)
Quelle est la couleur du cuivre métallique ?
3)
Donner les noms et les formules des espèces chimiques ioniques mises en
présence dans l’expérience 1.
4)
Que traduit le changement de coloration au cours de l’expérience 2 ?
5)
Expliquer en termes d’oxydation équation chimique à l’appui, ce qui s’est passé
au cours de l’expérience 2. En déduire du cuivre ou de l’argent quel est le
métal le plus réducteur.
6)
Citer deux domaines de la vie courante où, on peut associer utilement les
couples Cu++/Cu et Ag+/Ag
SOLUTIONS
EXERCICE
I :
1.
1.1-Oxydant :Ag+ //accepteur
d’électrons
Réducteur :Cu //donneur
d’électrons
Cu ⇀ Cu2+ + 2e
Ag+ + e ⇀ Ag
(1x) Cu ⇀ Cu2+ + 2e //on multiplie la première équation par1
(2x) 2Ag+ +2 e ⇀ 2Ag //on multiplie la deuxième équation par 2 de façon à
avoir le même nombre d’électrons partout.
Cu +2Ag+ + 2e ⇀Cu2+ + 2Ag +2e //on
fait la somme membre a membre
Soit Cu
+2Ag+ ⇀Cu2+ + 2Ag
2.1 Zn ⇀Zn2+ + 2e //oxydation
Au3+ +3e⇀Au //réduction
22. Oxydant : Au
Réducteur : Zn
// le donneur d’électrons est le
réducteur
2.3.
(3x) Zn ⇀Zn2+ + 2e
(2x)
Au3+ +3e⇀Au
3Zn +2Au3+ ⇀3Zn2+ +2Au
EXERCICE
II :
1.La
couleur bleue indique la présence des ions Cu2+ en solution.
2.Le zinc
s’oxyde et cède à la solution des ions Zn2+ selon la demi-équation
électronique.
Zn ⇀
Zn2+ +2e //oxydation
du zinc
Les
ions Cu2+, initialement présents dans la solution captent ces ions et
se dépose sous forme cuivre métallique. Il y a donc consommation des ions
cuivriques selon la demi-équation électronique.
Cu2+ + 2e⇀Cu
//réduction des ions cuivriques
D’où la disparition de la couleur bleue.
3.Masse du
cuivre déposée.
L’équation bilan est :
Zn +
Cu2+ ⇀ Zn2+
+ Cu
1mol 1mol 1mol 1mol
n(Cu2+)=cv
=0,2x 0,1 =0,02 mol
n(Cu2+)=n(Cu)<=
> n(Cu2+)=m(Cu)/M(Cu)=>
m(Cu)=M(Cu)xn(Cu2+)=63,5x0.02=1,27
g
EXERCICE III :
1.Equation bilan de cette réaction.
(1x) Mg⇀Mg2+ +2e
(2x) H3O+
+ e ⇀H2 + H2O
Mg + 2H3O+
⇀ H2 +Mg2+ +2H2O
2.
2.1 Non
Mg
+ 2H3O+ ⇀ H2 +Mg2+ +2H2O
1mol 2mol
1mol 1mol 2mol
n(Mg)=n(H3O+)/2
n(Mg)=m(Mg)/M(Mg)=5/24,3![]() =0,2057mol
=0,2057mol
n(H3O+)=CV=0,02x0,1=0,002 mol On constate que
n(Mg)> n(H3O+)/2=>les réactifs ne sont pas dans des proportions stœchiométriques. Le
magnésium est en excès.
n(H2)=n(H3O+)/2=0,002/2=0,001 mol
n(H2)=V/Vm =>V=0,001x25=25
cm3.
EXERCICE
IV :
1.Le métal cuivre libère deux électrons
pour devenir l’ion cuivrique au contact de la solution selon la
demi-équation :
Cu![]() +2e
+2e
L’ion argent de la solution capte un
électron pour devenir du métal argent selon la
demi-équation :
Ag+ +e![]()
L’équation globale est :
Cu
+ 2Ag+![]() Cu2+ +2Ag
Cu2+ +2Ag
La lame de cuivre se recouvre de l’argent
forme.
2.
n(Ag)=cv=0,1x0,1=0,01
mol
n(Ag)=m(Ag)/M(Ag) => m(Ag)=0,01x 108=1,08g.
3-
Cu + 2Ag+![]() Cu2+ +2Ag
Cu2+ +2Ag
1mol 2mol
1mol 2mol
n(Cu)=n(Ag)/2 <= >m(Cu)/M(Cu)=n(Ag)/2
=> m(Cu)=63,5xx![]() =0,317 g
=0,317 g
EXERCICE V :
1.
Zn +
Cu2+ ⇀ Zn2+ +
Cu
1mol 1mol 1mol 1mol
n(Cu2+)
=cv=0,1x0,2=0,02 mol
n(Zn)=m(Zn)/M(Zn)![]() = m(Zn)=0,02x65,4=1,308g
= m(Zn)=0,02x65,4=1,308g
2.
n(Cu2+) =n(Cu)= n(Zn)
<=> m(Cu)/M(Cu)=0,02 =>
m(Cu)=0,02x63,5=1,27g.
C=n(Zn2+)/V=0,02/0,2=0,1 mol/l
3.[zn2+] = [cu2+]=0,1 mol/l
EXERCICE VI :
a) Le fer s’est transformé en ion Fe++
qui donne la coloration verdâtre à la solution. Les ions cuivriques qui étaient
responsables.de la couleur bleue ont capté les électrons libérés par le métal
Fe et se sont transformées en cuivre métallique qui forme dépôt rougeâtre.
b) C’est une réaction
d’oxydo-réduction.
c) Fe →Fe++ +2e
Cu ++ +2e→Cu
d) Recopier et compléter les phrases suivantes :
Dans cette transformation, le fer a……perdu…deux
électrons ; le fer est un………réducteur………..,
il a subi une………oxydation……………. L’ion cuivrique a…………gagné………………..deux électrons ;l’ion
cuivrique est un ……oxydant …………….., il a subi
une ……réduction……………………..
EXERCICE VII :
.
1-Une solution molaire est une solution qui a pour concentration 1
mole par litre.
Un réducteur est une espèce chimique qui peut céder un ou plusieurs
électrons au cours d’une réaction chimique.
2) couleur rouge-brique
3) SO42- : ions sulfates
Cu2+ : ions cuivriques
4) Il y a eu oxydation du cuivre et réduction des ions Cu2+.
5) Expliquer en termes d’oxydation équation chimique à l’appui, ce
qui s’est passé au cours de l’expérience 2. En déduire du cuivre ou de l’argent
quel est le métal le plus réducteur.
Le cuivre s’est oxydé .il a cédé des électrons pour devenir des ions
C2+ selon la demi-équation électronique :
Cu →Cu++. +2e
Les ions Ag+ de la solution ont capté ces électrons pour former le
métal Ag selon la demi-équation électronique :
Ag+ +
e → Ag
L’équation bilan est :
Cu +2Ag+ →Cu++ + 2Ag
6) Fabrication des piles et transport d’énergie.
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez un commentaire