pH DES SOLUTIONS AQUEUSES
ACIDES ET BASES
Acide :
Selon la théorie de Bronsted, un acide est tout
corps susceptible de céder un proton H+ au cours d’une réaction
chimique.
Exemple : L’acide chlorhydrique HCl
HCl → H+ +
Cl-
Au cours de cette réaction, la molécule d’eau
arrache un proton H+ a la molécule de chlorure d’hydrogène pour
former l’ion hydronium H3O+. Ainsi, la molécule de HCl a cédé son proton à l’eau, HCl
est un acide au sens de Brönsted.
L’équation
bilan de la mise en solution du HCl est :
HCl + H2O → H3O+ +
Cl-
Les solutions acides sont des solutions
aqueuses ioniques qui contiennent des ions hydrogène H3O+
et des ions négatifs qui les accompagnent pour que la solution soit globalement
électriquement neutre.
Autres
acides :
acide sulfurique H2SO4
acide nitrique :HNO3
Base :
Selon la théorie de Bronsted, une base est tout
corps susceptible de fixer des protons H+ au cours d’une réaction
chimique.
Exemple : L’hydroxyde de sodium NaOH
L’équation de mise en solution de NaOH est :
NaOH
→ Na+ + HO-
Les ions HO- réagissent sur les
protons H+ pour former de l’eau selon l’équation :
HO-
+ H+ →H2O
Les ions HO-
sont susceptibles de fixer des protons : NaOH
est une base au sens de Brönsted.
Les propriétés de la solution aqueuse obtenue sont
essentiellement celles des ions HO-.
Les ions Na+ étant très peu réactifs.
Les solutions basiques sont des solutions
aqueuses ioniques qui contiennent des ions hydroxyde HO- et des ions
positifs qui les accompagnent pour que la solution soit globalement
électriquement neutre.
Autres bases : Ammoniac : NH3
Hydroxyde de potassium ou Potasse : KOH
Amphotère :
C’est une substance qui peut se comporter
selon les conditions comme un acide de Bronsted et comme une base de Brönsted.
Exemple :
Une molécule
d’eau s’ionise en libérant un proton selon l’équation :
H2O → HO- + H+
Le proton
libéré est solvaté (hydraté) par une autre molécule d’eau selon
l’équation :
H2O
+ H+→H3O+
Au cours de
la première étape, l’eau cède un proton, elle se comporte comme un acide au
sens de Brönsted. Au cours de la seconde étape, l’eau fixe un proton, elle se
comporte comme une base au sens de Bronsted. L’eau peut se comporter, tantôt
comme un acide, tantôt comme une base : c’est une substance amphotère.
Remarque :
On précise à
chaque fois « au sens de Brönsted « parce qu’il existe une autre
définition hors-programme des acides et bases au sens d’Arrhenius.
DEFINITION ET MESURE DU PH
Toute solution aqueuse contient des ions H3O+.
Les propriétés acides ou basiques d’une telle solution dépendent de la
concentration molaire en ions H3O+. Cette concentration généralement
faible, s’exprime en puissances négatives de 10.
Le pH
(potentiel hydrogène) est une
grandeur sans unité associée à la concentration des ions H3O+
Par la formule :
pH =-log[H3O+] =10-pH <=> [H3O+]=10-pH
[H3O+] est exprimée en mol.l-1
Mesure du pH :
On peut
utiliser :
-utiliser un
pH-mètre
-utiliser le
papier pH
-utiliser
les indicateurs colorés.
Importance
du pH
-Dans l’agriculture,
la bonne croissance des plantes ne peut s’effectuer que dans un domaine de pH
bien déterminé. Certaines plantes exigent des sols acides, d’autres des sols
basiques.
-Dans
l’industrie chimique, la connaissance des pH de nombreuses solutions permet de
prévoir leur utilisation pour des opérations bien précises.
pH DES SOLUTIONS ACIDES, BASIQUES OU NEUTRES.
Toutes les solutions aqueuses (dans l’eau)
sont neutres, acides ou basiques.
a. Une solution neutre est obtenue quand la concentration des ions hydronium
est égale à la concentration d’ions hydroxyde :
[H3O+]
= [OH-]
b. Une solution acide est obtenue quand la concentration des ions hydronium est
supérieure la concentration d’ions hydroxyde :
[H3O+]
> [OH-]
c. Une solution basique est obtenue quand la concentration des ions hydronium
est inférieure la concentration d’ions hydroxyde :
[H3O+]
< [OH-]
. La plupart des concentrations
d’ions hydronium sont très faibles (c.-à-d. 4 × 10-8 mol/L ou 0,000
000 04 mol/L) d’où la proposition de potentiel d’hydrogène, l’échelle
de pH par Soeren Sorensen.
|
Le pH est une grandeur qui permet de classer les solutions acides,
basiques ou neutres. Une solution aqueuse est : -Basique si son pH est supérieur à 7 -Neutre si son pH = 7 |
Exemple :
Une solution de pH= 3 est
une solution acide dont la concentration molaire en ions H3O+
est [H3O+]= 10-3 mol.L-1
Remarques :
Plus le pH est élevé, plus la
concentration en ions H3O+ est faible et plus la solution
est basique
Plus pH est faible, plus la
concentration en ions H3O+ est élevée et plus la solution
est acide
PRODUIT IONIQUE DE L’EAU
Dans toute solution aqueuse, le produit
des concentrations molaires des ions H3O+ et HO-
à l’état d’équilibre et à une température donnée, est une constante appelée constante
d’équilibre d’autoprotolyse de l’eau. Cette constante notée Ke.
Ke est aussi
appelée produit ionique de l’eau.
Ke=[H3O+][HO-]
Ke est un nombre sans dimension qui dépend de la
température.
A 25°C, on a Ke =10-7.10-7=10-14
|
- Pour une solution neutre, pH=7 <=>[H3O+]=[HO-]=>pH=1/2pKe |
DOMAINE
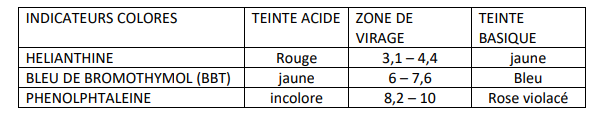
DE VIRAGE DE QUELQUES INDICATEURS COLORES
Un indicateur coloré (IC) est un corps qui change de couleur
suivant le pH de la solution dans laquelle il est introduit. Ce changement de
couleur se fait dans un domaine de pH bien déterminé appelé zone de virage.
La coloration prise par un indicateur coloré dans sa zone de virage est appelé sa teinte sensible. Le tableau ci-dessous
indique les zones de virages et les colorations de quelques IC.
EXERCICES
EXERCICE
I :
1.On donne
les substances suivantes et les équation-bilans de leur mise en solution :
-Substances: NH3; CH3COOH; HNO3; H2O;
KOH.
-Equations
de mise en solution :
NH3 +
H2O →NH4+ +
HO-
CH3COOH + H2O→ CH3COO- +H3O+
HNO3 + H2O → NO3- + H3O+
H2O + H2O → H3O+ + HO-
KOH → K+ + 3 HO-
Parmi les substances
ci-dessus, indiquez :
a) Celle(s)
qui est (sont) des acides selon Brönsted.
b) Celle(s)
qui est (sont) des bases selon Brönsted.
c) Celle(s)
qui, selon les conditions, peut (peuvent) être des acides ou des bases selon
Brönsted.
Justifier
votre réponse
2. Indiquez
les équations des réactions des substances ci-dessous avec l’eau :
a) HCl
b) NaOH
c) H2SO4
Déduire si
elles sont acides ou bases de Brönsted
3. Complétez la phrase suivante :
"lorsqu'un
acide réagit avec l'eau, il y a toujours formation ………………………………………………"
"lorsqu'une
base réagit avec l'eau, il y a toujours formation ………………………………………………"
EXERCICE II :
1.Le
dihydrogène brûle dans du dichlore en donnant du chlorure d’hydrogène, on brûle
un excès de dihydrogène dans 200 cm3 de dichlore. Volume mesuré dans
les conditions ou le volume molaire vaut 25 l.
1.1-Quel volume de chlorure d’hydrogène
obtient-on ?
1.2-Quelles quantités en moles, de dihydrogène
a-t-elle été consommée ?
2.
On dissout 120 cm3, volume mesuré dans les conditions ou le volume
molaire vaut 24 l, de chlorure d’hydrogène dans l’eau de façon à obtenir 250 cm3
de solution.
2.1-Quelle est la concentration molaire de la
solution obtenue ?
2.2-Déterminer la concentration des ions
hydronium ainsi que celle des ions chlorure.
EXERCICE
III :
1.On
dissout 2,3g d’hydroxyde de sodium dans l’eau de façon à obtenir 150 ml de
solution. Déterminer la concentration molaire des ions sodium et des ions
hydroxydes dans cette solution.
2.On
se propose de préparer au laboratoire des solutions d’hydroxyde de sodium.
2.1-Quelle masse de pastilles de soude faut-il
dissoudre dans l’eau pour obtenir 100 cm3 d’une solution
molaire ?
2.2-On prélève 10 cm3 de la solution
préparée, on les verse dans une fiole jaugée de 1l et on complète avec l’eau
distillée jusqu’au trait de jauge. Déterminer la concentration molaire des ions
hydroxydes dans la solution diluée.
EXERCICE
IV :
1.Le pH du lait
de vache est 6,5. Calculer la concentration en ions hydronium et hydroxyde dans
ce lait.
2.La
concentration des ions hydroxydes dans une solution aqueuse est égale à 10-3 mol.l-1.
2,1-Calculer la concentration des ions hydronium et le
pH de cette solution.
2.2-Quelle est la couleur prise dans cette solution
par :
a-le bleu de bromothymol
b-la phénolphtaléine
c-l ’hélianthine.
2.3-Dire, en justifiant votre réponse, s’il peut
s’agir :
a-d ’une solution d’acide
chlorhydrique
b-d ’une solution d’hydroxyde de
sodium
c-de l’eau pure
EXERCICE
V :
On prépare
une solution d’hydroxyde de sodium en dissolvant dans l’eau 2g de cristaux
anhydres et en complétant le volume a 250 ml.
1.Déterminer
la concentration C de la solution
2.Calculer
les concentrations des ions hydroxyde et hydronium
3.En déduire
le pH de la solution
EXERCICE VI :
On prépare
deux solutions décimolaires en faisant barboter dans
l’eau, d’une part du chlorure d’hydrogène (solution A), d’autre part de
l’ammoniac (solution B).
1.Quelle
masse de chlorure d’hydrogène et quel volume d’ammoniac (mesuré dans les
conditions ou le volume molaire est 24 l) a-t-il fallu dissoudre dans 250 ml
d’eau pour obtenir les solutions A et B ?
2.Ecrire les
équations bilans traduisant l’action de l’eau sur le chlorure d’hydrogène et
l’ammoniac.
3.Rappeler
la définition d’un acide et celle d’une base selon Bronsted.
4.Parmi les
espèces chimiques figurant dans les équations précédents, indiquer celles qui,
dans ce cas précis, se comportent comme des acides et celles qui se comportent
comme des bases.
5.Que
peut-on dire du comportement de l’eau ?
6.Quel est
pH de la solution A ?
7.Peut-on
déduire la valeur exacte du pH de la solution B à partir des données
précédentes ? pourquoi ?
8.Dire si le
pH de la solution B est inférieur, supérieur ou égal à celui de l’eau pure.
EXERCICE VII :
1.Classer
par ordre croissant de leur acidité les solutions suivantes :
S1 :pH=3,8
S2 :[HO-]=10-3 mol.l-1
S3 :[H3O+]=[HO-]
S4 :[H3O+]=5.10-3
mol.l-1
S5 :pH=8
2.Quel est
le pH d’une solution d’acide sulfurique de concentration 5.10-4 mol.l-1.
CORRIGES
EXERCICE
I :
1.
Acides selon Brönsted : CH3COOH (acide
acétique), HNO3(acide nitrique).
En
solution ils libèrent un proton H+ qui s’associe à l’eau pour former
l’ion hydronium H3O+(oxonium).
Bases selon Brönsted : NH3(ammoniac) ;
KOH (hydroxyde de potassium ou Potasse).
En
solution, ils libèrent l’ion HO- qui fixe un proton H+
pour former l’eau.
Amphotère : H2O.
2.
a)
HCl + H2O →H3O+ + Cl-
b)
NaOH → Na+ + HO –
c) H2SO4 + 2H2O →
2H3O+ + SO42–
3.
Lorsqu'un
acide réagit avec l'eau, il y a toujours formation d'ion hydronium H3O+.
Lorsqu'une base réagit avec l'eau, il y a toujours
formation d'ion hydroxyde HO-.
EXERCICE II :
1.
1.1- volume de chlorure d’hydrogène obtenu
H2 +
Cl2 → 2HCl
1mol 1mol 2mol
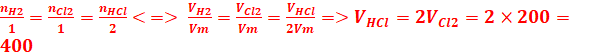 cm3.
cm3.
1.2-quantité en moles, de dihydrogène consommé
![]()
2.
2.1-concentration molaire de la solution obtenue
n=VHCl/Vm=0,120/24=5.10-3 mol
c=n/V=510-3 /0,25=2. 10-2mol.l-1.
2.2- concentration des ions hydronium ainsi que celle des ions
chlorures
HCl + H2O →
H3O+ +
Cl-
1mol 1mol 1mol
[H3O+]=[Cl-]=[HCl]= 2.10-2mol.l-1.
EXERCICE III :
1.Hydroxyde de sodium : NaOH
M=23+16+1=40g.mol.l-1
C=n/V=m/MV=2,3/40x0,15=0,383 mol.l-1.
2.
2.1-masse de pastilles de soude
C1=1mol.l-1
C1=m/MV=>m=CVM=1x0,1x40=4 g
2.2- concentration molaire des ions hydroxydes dans la solution
diluée
C1V1=C2V2
=>C2= C1V1/V2=1x10/1000=10-2
mol.l-1.
EXERCICE
IV :
1.
concentration en ions hydronium et hydroxyde
[H3O+]=10-pH
=10-6,5=3,16.10-7 mol.l-1.
[HO+][HO-]=10-14
=>[HO-]=10-14/[H3O+]=10-14/3,16.10-7
= 3,16.10-8 mol.l-1.
2.La
concentration des ions hydroxyde dans une solution aqueuse est égale à 10-4
mol.l-1.
2,1-Calcul
de la concentration des ions hydronium et le pH de cette solution.
[H3O+][HO-]=10-14
=>[H3O+]=10-14/[HO-]=10-14/10-4=10-10
mol.l-1.
[H3O+]=10-pH=10-10 => pH=10.
2.2-
couleur prise dans cette solution :
a- bleu
b-rose violace
c-jaune
2.3-
b- solution d’hydroxyde de sodium car pH>7
EXERCICE
V :
1. concentration C de la solution
M=23+16+1=40g.mol.l-1
C=n/V=m/MV=2/40x0,25=0,2 mol.l-1
2.
concentrations des ions hydroxyde et hydronium
[HO-]=C=0,2 mol.l-1
[H3O+] =10-14/[HO-]=10-14/0,2=5.10-14
mol.l-1
3.
pH de la solution
pH=-log[H3O+]=-log5.10-14=13,3.
EXERCICE VI :
1.
masse de chlorure d’hydrogène et volume d’ammoniac
CA=CB
=0,1 mol.l-1 //solution decimolaire
VA=VB=250
ml
nA=CAVA=0,1x0,25=0,025
mol
nA=mA/MA
=> mA=nAxMA=0.025x36,5=0,91
g
nB=CBVB=0,1x0,25=0,025
mol
nB=VB/Vm => VB=nBVm =0,025x24=0,6 l.
2.équations
bilans traduisant l’action de l’eau sur le chlorure d’hydrogène et l’ammoniac.
HCl + H2O →H3O+ + Cl-
NH3 + H2O
⇆ NH4+ + HO-
3.
Acide : Selon la théorie de Bronsted, un acide est tout corps
susceptible de céder un proton H+ au cours d’une réaction chimique.
Base : Selon la théorie de Bronsted, une base est tout corps
susceptible de fixer des protons H+ au cours d’une réaction
chimique.
4.
Acide: HCl, H2O
Base: NH3, H2O // l’équation de la
deuxième réaction traduit
un équilibre. Dans ce cas NH4+ est acide au cours de la réaction inverse.
C’est l’acide conjugué de la base NH3 (cours Tle)
5.Amphotère.L’eau
est un ampholyte.
6.pH=-logCA=-log0,1=1 // la solution A est acide de pH=-logCa.
7.
non, c’est une base faible. La dissociation n’est pas totale. //Pour trouver le pH,
la notion de constante d’acidité pKA intervient
(cours Tle)
8.
le pH de la solution B est supérieur à celui de l’eau pure (pH>7).
EXERCICE VII :
1.
S1 :pH=3,8
S2 :[HO-]=10-3
mol.l-1=>[H3O+]=10-14/[HO-]=10-14/10-3=10-11
=>pH=11
S3 :[H3O+]=[HO-] =>pH=7
S4 :[H3O+]=5.10-3 mol.l-1=>pH=-log5.10-3=2,3
S5 :pH=8
Classement :S2,S5,S3,S1,S4
2.pH=-log2c=-log2x5.10-4=-log10-3=3 //c’est un diacide.
Avez-vous
un exercice a proposer?Cliquez-ici
Merci de votre visite
Laissez un commentaire