ACIDES α-AMINES
DEFINITION
ET NOMENCLATURE
. Les acides α-aminés sont
des composés organiques qui comportent une fonction acide carboxylique et une
fonction amine liées au même atome de carbone.
Formule générale :
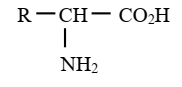
|
|
Groupe fonctionnel acide α-aminés :
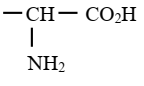
Nomenclature
La fonction acide carboxylique est
plus réactive que la fonction amine. Elle constitue donc la fonction
principale. Les acides α-aminés sont alors désignés
comme des dérivés substitués des acides carboxyliques. Pour les nommer, on
attribue le numéro 1 à l’atome de carbone du groupe –COOH ; le groupe –NH2
considéré comme substituant est appelé groupe amino.
Il est toujours lié à l’atome de carbone numéro 2.
Exemples : acide 2-aminoethanoique
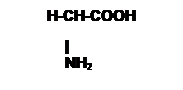
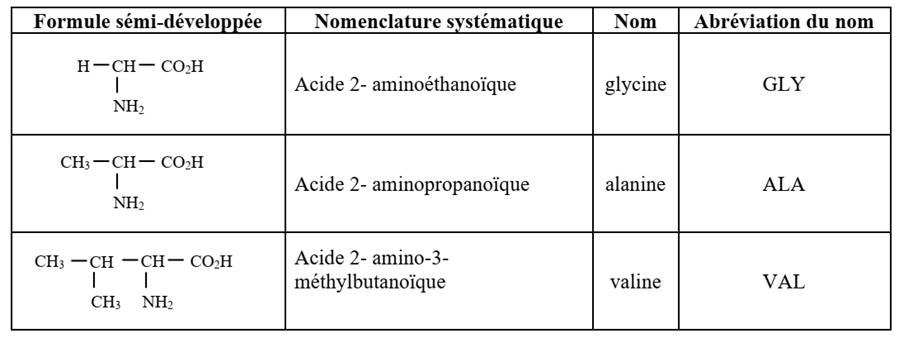
La plupart des acides aminés portent
des noms usuels et des abréviations officielles trois lettres. Ainsi, les
composés cités ci-dessous portent dans l’ordre les noms et les abréviations
suivants : glycine (gly), alanine (ala) et valine (val).
Exemples :
PROPRIETES
ACIDO-BASIQUE DES ACIDES α-AMINES
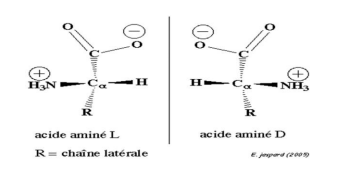
La présence simultanée
d’une fonction acide carboxylique –COOH capable
de libérer un proto H+, et d’une fonction amine basique capable de
capter un proton H+ au sein d’une molécule α-aminé, conduit à
la neutralisation intramoléculaire. Le transfert d’un proton H+ à
l’intérieur de la même molécule aboutit à la formation d’un ion dipolaire
(comportant une charge positive et une charge négative) appelé Amphion ou zwitterion.
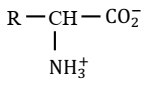
Il est plus approprié de présenter les acides α-aminés à l’état pur
les sous forme d’Amphion. Cette espèce chimique est globalement électriquement
neutre. Dans l’eau pure, les acides α-aminés existent pratiquement sous
forme d’Amphion.
-L’amphion possédant un ion carboxylate -COO-
peut capter un proton H+ et devenir
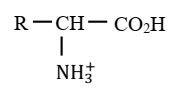 cation
cation
Donc l’amphion est une base au sens de Bronsted.
-L’Amphion possédant un ion carboxylate -NH3+ peut
céder un proton H+ et devenir
 anion
anion
Donc L’Amphion est un acide au sens de Bronsted.
L’amphion présente à la fois un caractère acide et un caractère
basique : C’est un amphotère.
LA
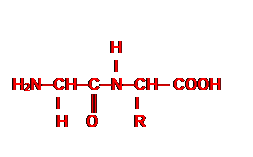
LIAISON PEPTIDIQUE
On appelle liaison peptidique la liaison qui se forme par élimination d’une
molécule d’eau entre le groupe amine d’un acide α-aminé
et le groupe carboxyle de l’autre.
La liaison peptidique résulte de la
condensation entre le groupe carboxyle (-COOH) d’un acide α-aminé et le
groupe amine (-NH2) d’un autre acide α-aminé. Le corps obtenu
est appelé un dipeptide.
Exemple : le dipeptide ALAGLY
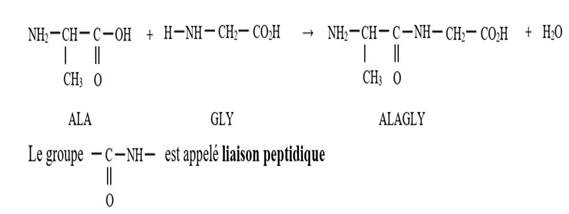
·
Par convention, pour représenter un
dipeptide, on écrit à gauche le symbole de l’acide α-aminés qui a
la fonction amine libre.
·
Pour désigner un polypeptide, on nomme successivement, par leurs
abréviations, tous les acides α-aminés dont il dérive en commençant par
l’extrémité de la chaîne qui porte le groupe-NH2 libre (acide
α-aminé N terminal) et en terminant par celle qui porte le groupe -COOH
libre (acide α-aminé C terminal)
Hydrolyse de la liaison peptidique
L’hydrolyse d’un dipeptide donne les deux acides α-aminés de départ
qui ont permis d’obtenir le
dipeptide.
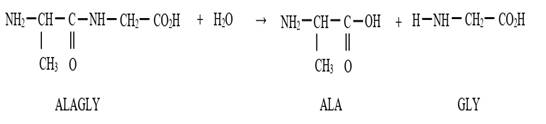
·
Caractérisation de la liaison
peptidique
La réaction de Biuret permet de caractériser la liaison peptidique dans des
molécules (molécules ayant au moins deux liaisons peptidiques).
·
Les protéines
Un dipeptide possède comme un acide α-aminé, deux groupes lui
permettant de former des nouvelles liaisons peptidiques avec deux autres
molécules d’acides α-aminés. On peut obtenir ainsi un tripeptide, puis un tétrapeptide, etc … Si on
continue la condensation, on obtiendra des polypeptides composés de plusieurs
acides α-aminés reliés entre elles par des liaisons peptidiques. Quand le
nombre d’acides α-aminés est encore plus important on ne parle plus de
polypeptides mais de protéines.
Comment procéder pour obtenir un dipeptide donné à partir de deux acide α-aminés N ?
-On bloque les groupes fonctionnels qui ne
doivent pas réagir.
-On active les groupes qui doivent réagir.
-On régénère les fonctions bloquées
lorsque la liaison peptidique a été
réalisée.
Exemple : Réalisons la liaison Ala-Gly (et non Gly-Ala)
Pour bloquer la
fonction amine, on la transforme en amide en utilisant un chlorure d’acyle.
NH2-CH(CH3)-COOH +CH3-COCl →CH3-CO-NH-CH(CH3)-COOH
+HCl
Pour activer la
fonction acide, on la transforme en chlorure d’acyle plus réactif.
CH3-CO-NH-CH(CH3)-COOH +SOCl2→ CH3-CO-NH-CH(CH3)
- COCl +HCl
Pour bloquer la
fonction acide, on le transforme en ester par action sur un alcool.
CH2(NH2)-COOH + C2H5-OH →
CH2(NH2)-COO(C2H5) + H2O
En resume,
CH3-CO-NH-CH(CH3) - COCl
+ H-HN-CH2-COO(C2H5) → CH3-CO-NH
- CH(CH3) - CO-NH-CH2 -COO(C2H5) +
HCl
Il reste à regénérer
les fonctions bloquées.
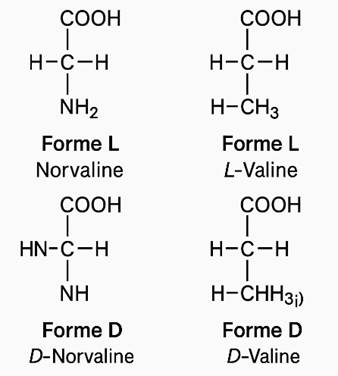
CHIRALITE DES MOLECULES
Carbone asymétrique
Un atome de carbone tétraédrique est dit asymétrique s’il est relié à
quatre atomes ou groupe d’atomes tous différents.
A l’exception de la glycine, tous les acides α-aminés renferment dans leurs
molécules au moins un carbone asymétrique
Conséquences de
la présence d’un carbone asymétrique dans une molécule : chiralité
La présence du carbone asymétrique noté C* confère à la molécule deux formes spatiales ou configurations non
superposables. Elles se distinguent l’une de l’autre comme un objet
asymétrique de son image dans un miroir plan. Ces deux formes spatiales
différentes d’un même composé sont appelées stéréo-isomères.
Une molécule qui n’est pas superposable à son image dans un miroir plan
est dite chirale. Une molécule qui
n’est pas chirale est achirale. Des
paires de stéréo-isomères sont appelés
énantiomères.
On appelle énantiomères un
couple isomères de configurations non superposables, images l’un et l’autre
dans un miroir. Une molécule chirale existe sous deux formes énantiomères. Un mélange
racémique est un mélange en quantités égales, de deux énantiomères.
Les énantiomères ont des propriétés physiques et chimiques identiques à
deux exceptions près :
-ils peuvent réagir de manière différente
avec d’autres composés chiraux.
-ils sont optiquement
actifs c.-à-d. ils sont doués d’un
pouvoir rotatoire.
Une substance chirale à la propriété de
faire tourner d’un angle α le plan de polarisation de toute lumière
polarisée qui la traverse :
·
Quand la rotation a lieu
dans le sens de rotation des aiguilles d’une montre, la substance est dite dextrogyre, l’angle α est compté
positivement.
·
Quand la rotation a lieu
dans le sens inverse de rotation des aiguilles d’une montre, la substance est
dite lévogyre, l’angle α est
compté négativement.
Conclusion : La plupart des acides aminés sont
des molécules chirales car ils
contiennent un carbone asymétrique. Ce carbone, centre de la chiralité est lié
à quatre substituants différents. Seule la glycine ne comporte pas de carbone asymétrique et n'est donc pas une molécule chirale.
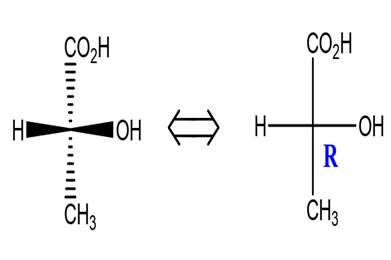
Représentation de Fischer
Le principe de la représentation de
Fischer est le suivant :
-On écrit verticalement la chaîne carbonée principale
en plaçant en haut le carbone ayant le plus petit indice en nomenclature
(carbone le plus oxydé).
-Les liaisons dirigées vers l’observateur sont placées sur l’horizontal.
-Les liaisons dirigées vers l’arrière sont placées sur la verticale.
-Au croisement de la verticale et de l’horizontal c’est le C asymétrique (C*).
EXERCICES
EXERCICE I :
L’acide aspartique est un acide ɑ-aminé
de formule brute : C4H7O4N.
1.
Ecrire sa formule semi-développée.
2.
Citer tous les groupes fonctionnels présents dans cette molécule.
3.
Donner son nom en nomenclature systématique.
EXERCICE II :
Un acide ɑ-aminés a pour formule
brute : C5H11O2N.
1.
Ecrire toutes les formules semi-développée possibles. Donner leurs noms.
2.
Parmi les isomères trouvés, quels sont ceux dont les molécules sont
chirales ?
3.
Donner la représentation de Fisher des deux énantiomères. Préciser la
configuration de chaque énantiomère.
EXERCICE III :
On réalise la synthèse d’un dipeptide
à partir de la glycine et d’un acide ɑ-aminé X.
1.
Ecrire la formule générale d’un acide ɑ-aminé.
2.
La masse molaire du dipeptide est 132g.mol-1. Déterminer la nature
du radical de X.
3.
Donner la formule semi-développée et le nom de X.
Sa
molécule est-elle chirale ? Pourquoi ?
EXERCICE IV :
On considère un acide ɑ-aminé A
de masse molaire M =131g.mol-1, dont le groupe R est un radical
alkyle saturé à une seule ramification.
1.
Déterminer la formule brute de A.
2.
La molécule de A ne comporte qu’un seul atome de carbone asymétrique. En
déduire sa formule semi-développée. Préciser son nom en nomenclature
systématique.
3.
Pourquoi peut-on dire que A présente un caractère amphotère ?
EXERCICE V :
Lors d’une séance de préparation d’un devoir de niveau, votre professeur
vous demande dans un exercice d’identifier un acide α-aminé B qui sert de
réactif dans la synthèse d’un composé organique D. Au cours de cette synthèse,
l’acide α-aminé B de formule 𝑅𝐶𝐻(𝑁𝐻2 )𝐶𝑂𝑂𝐻 où R est un groupe alkyle saturé , réagit avec
la valine de formule semi-développée 𝐶𝐻3𝐶𝐻(𝐶𝐻3 )𝐶𝐻(𝑁𝐻2 ). Cette réaction
conduit à un dipeptide dont la masse molaire est 𝑀 = 188𝑔/𝑚𝑜𝑙 Les masses molaires atomiques en g/mol des éléments chimiques
intervenant dans les formules sont : H (1) ; C (12) ; O (16) ; N (14). Ton
voisin qui était appelé à résoudre l’exercice au tableau, peine à le faire. Ton
professeur te désigne pour le remplacer.
1. Donne :
1.1.Le nom systématique de
la valine.
1.2.Le nom du type
particulier de la liaison rencontrée dans le composé D
2. Explique ce qu’il faut faire pour obtenir qu’un
seul dipeptide, celui où B est l’acide α-aminé terminal.
3. Ecris l’équation de la réaction chimique entre la
valine et le composé D.
4. Détermine le groupe alkyle R du composé B.
5. Identifie
B (formule semi-développée et nom).
CORRIGES
 EXERCICE I :
EXERCICE I :
1. Formule semi-développée
de l’acide aspartique
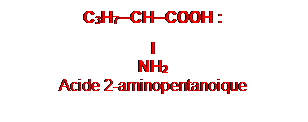
2. Groupes fonctionnels
présents dans cette molécule
─ NH2 : groupe
amine
─COOH :
groupe carboxylique
3. Nom en
nomenclature systématique de l’acide aspartique.
Acide
2-aminobutane-1,4-dioique
EXERCICE
II :
1. Formules
semi-développée possibles
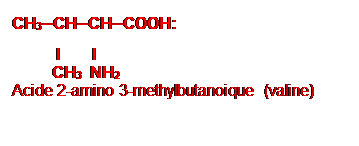 Acide 2-aminopentanoique
Acide 2-aminopentanoique
 Acide 2-amino
3-methylbutanoique (valine)
Acide 2-amino
3-methylbutanoique (valine)
// Acide 2-amino-2-méthylbutanoïque
CH3
|
H3C–CH(NH2)–CH2–COOH
(NB : ce dernier n’est pas un acide α-aminé au sens strict
car le groupe NH2 n’est pas sur le carbone α du COOH.)
2.
Acide 2-aminopentanoïque
(CH3–CH2–CH2–CH(NH2)–COOH)
→ Le carbone α (celui
portant –NH2) est lié à :
- un groupe –NH2
- un groupe –COOH
- un groupe –CH2CH2CH3
- un hydrogène
⇒ Il est
asymétrique
. Acide 2-amino-3-méthylbutanoïque
((CH3)2CH–CH(NH2)–COOH)
→ Le carbone α est lié à :
- un groupe –NH2
- un groupe –COOH
- un groupe isopropyle
(–CH(CH3)2)
- un hydrogène
⇒ Il est asymétrique
⇒ Il est asymétrique
3.
EXERCICE
III :
1. Formule générale d’un acide ɑ-aminé.
R─CH─COOH
I
NH2
 2. Nature du radical de X.
2. Nature du radical de X.
M=MR+ 7+28+48+48= MR+131
<=> 132= MR+131 =>MR=1
C’est l’atome d’hydrogène
3. Formule semi-développée et le nom de X.
![]()
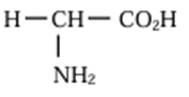
Sa molécule n’est pas chirale car il n’y a pas de carbone
asymétrique.
EXERCICE
IV :
1. Formule brute de A.
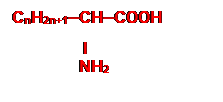
M=12n +2n+1 +24+4+14+32=14n+75 <= > 131=14n+75. => n =4
Formule brute :C6H13O2N
2. Formule semi-développée.
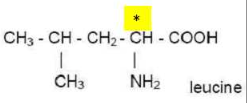 Acide 2-amino 4-methylpentanoique
Acide 2-amino 4-methylpentanoique
3. En solution aqueuse, le groupe acide carboxylique (-CO2H)
de A a
tendance à céder un proton H+ (acide de Bronsted) alors que
le
groupe amine (-NH2) de A a
tendance à capter un proton H+ (base de Bronsted).
A présente donc à la fois un caractère acide et un caractère basique :
C’est un amphotère.
EXERCICE V :
1.
1.1.Le nom
systématique de la valine : Acide 2-amino-3-methylbutanoique
1.2.Le nom du
type de liaison dans D La liaison peptidique
2.
J’explique ce qu’il faut faire Il faut d’une part bloquer ou désactiver les
groupes qui participent aux réactions non souhaitées et d’autre part activer
l’un des groupes participant à la réaction voulue.
3. J’écris l’équation.
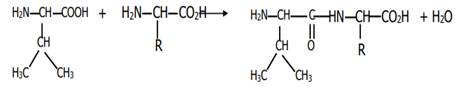
4. Je détermine le groupe alkyle R : La
formule de R est 𝐶𝑛𝐻2𝑛+1 𝑀(𝑅 −)
= 12𝑛 + (2𝑛 + 1) + 1 = 14𝑛 + 1 𝑀(𝑅 −)
= 𝑀 − (7𝑀𝐶 + 13𝑀𝐻 + 7𝑀𝑁 + 3𝑀𝑂) = 188 − (7 × 12 + 13 × 1 + 2 × 14 + 3 × 16 𝑀(𝑅 −) = 15 14𝑛 + 1 = 15 𝑛 = 15−1 14 = 1 ⇒ 𝑅 −
𝑒𝑠𝑡 𝑙𝑒 𝑔𝑟𝑜𝑢𝑝𝑒 𝑚𝑒𝑡ℎ𝑦𝑙𝑒 (𝐶𝐻3−)
5. J’identifie B Formule semi-développée : Nom : Acide 2-aminopropanoique
(Alanine).