LES AMINES
DEFINITION ET NOMENCLATURE
. Une amine résulte du
remplacement d’un ou plusieurs atomes d’hydrogène dans la molécule d’ammoniac
(NH3) par un ou plusieurs groupements alkyles ou aryles.
Ainsi, les amines saturées ont pour formule brute générale CnH2n+3
N.
Les trois classes d’amine
Il existe trois classes d’amines
selon que l’atome d’azote porte un,deux ou trois groupesakyles ouatyles. Elles
sont appelees respectivement amiines primaires,amines secondaires et amines
tertiaires de ormules generales.

Les radicaux
R1, R2, R3 peuvent être identiques ou
différents : ce sont les amines aliphatiques. Si le radical est groupe
aryle, l’amine est dite aromatique.
Nomenclature des amines
Cas des amines linéaires
Première méthode :
- Les amines sont nommées en remplaçant le « e » final de l’alcane dont
elles proviennent par « amine »
avec indice de position du groupe NH2.
- L’atome de carbone lié à l’atome d’azote porte le numéro 1.
- Si l’amine est secondaire ou tertiaire, on énonce les autres groupes devant,
précédés de la lettre N ou des
lettres N, N.
Exemple :
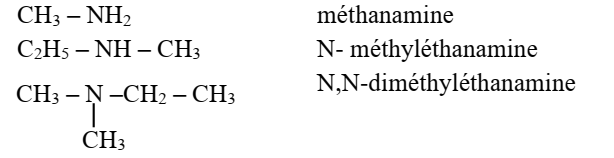
Deuxième méthode
- Les amines primaires sont nommées en alkylamines
où le groupe alkyle est la partie liée au
groupe NH2.
|
- |
Si l’amine est secondaire ou tertiaire, on énonce
les autres groupes devant, précédés de la lettre N ou N, N |
Exemple :
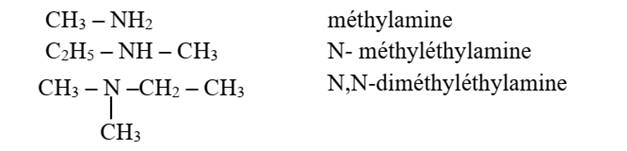
Cas des amines cycliques
La nomenclature des amines cycliques
suit les règles de l'IUPAC et dépend de la structure de l’amine (primaire,
secondaire ou tertiaire) et de la nature du cycle.
1. Amines cycliques simples (amine
primaire)
Quand le groupe amine est lié à un
cycle sans substitution sur l’azote, on utilise le nom du cycle suivi de
"amine".
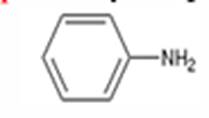
2. Amines secondaires ou tertiaires
cycliques
Quand l’azote est inclus dans le
cycle (cycle azoté), on utilise des noms spécifiques :

3. Substituants sur l’azote
Quand des groupes alkyles sont fixés
sur l’azote, on les mentionne avec le préfixe N- :
- N-méthylcyclohexylamine
: un groupe méthyle sur l’azote d’une cyclohexylamine
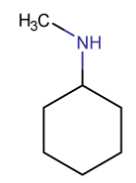
- N,N-diméthylcyclohexylamine : deux groupes méthyle sur l’azote
PROPRIETES CHIMIQUES DES
AMINES
Structure de Lewis de l’azote :
![]()
On observe :
-3 électrons célibataires
-1 doublet non liant (libre).
Caractère
basique des amines
Les amines sont des bases
du fait du doublet libre sur l’atome d’azote. Ce sont des bases de Bronsted
c.-à-d. des
espèces chimiques capables de capter des protons H+ .
R-NH2 + H2O ⇌
R-𝑁+H3 + HO-
Il
se produit une réaction qui consiste en l’arrachement du proton par le doublet
libre de l’azote. Par exemple, pour la réaction de la méthylamine avec l’eau,
on a :
![]()
La dissociation n’est pas
totale, donc les amines sont des bases faibles.
Caractère
nucléophile des amines
Le doublet non liant de
l’azote confère aux amines un caractère nucléophile.
- Le nucléophile est une
espèce riche en électrons qui peut donner une paire d’électrons pour former une
liaison avec un atome déficient en électrons (un électrophile).
- Dans les amines (R-NH₂, R₂NH, R₃N), l’atome d’azote
possède un doublet non liant (ou libre), non engagé dans une liaison.
- Ce doublet est
disponible pour attaquer un site électrophile, comme un carbone déficient en
électrons dans une molécule.
Donc, ce doublet libre
rend l'azote capable de former une nouvelle liaison, ce qui donne à l’amine un
comportement nucléophile typique dans de nombreuses réactions organiques, comme
la substitution nucléophile
*Réaction d’Hofmann (alkylation des amines).
L’azote (centre nucléophile)
attaque le carbone (centre électrophile) dans la molécule halogénée R-X
(X=I, Br, Cl…).
·
Cas d’une amine
tertiaire
Une amine tertiaire réagit avec un dérivé halogéné pour donner un ion
ammonium quaternaire stable appelé ion alkylammonium.
Exemple : L’alkylation de la N,
N-diéthyléthylamine.
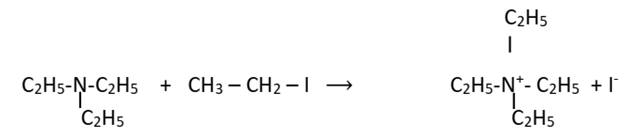
·
Cas des amines
primaires et secondaires
L’action d’une amine primaire sur un dérivé halogéné conduit à la
formation successive des amines secondaires et tertiaires, et finalement, à
celle d’un ion ammonium quaternaire.
1.
Première alkylation
Méthanamine + Iodoéthane
→ Éthylméthylamine (amine secondaire) + Iodure
d’hydrogène
CH3NH2
+ C2H5I → CH3NHCH2CH3
+ HI
2.
Deuxième alkylation
L’amine
secondaire formée peut réagir à nouveau :
Éthylméthylamine + Iodoéthane
→ Diéthylméthylamine (amine tertiaire) + HI
CH3NHCH2CH3 + C2H5I
→ CH3N(CH2CH3)2 + HI
3. Troisième alkylation
L’amine
tertiaire peut encore réagir pour former un sel d’ammonium quaternaire :
Amine
tertiaire + Iodoéthane → Ion ammonium
quaternaire (iodure de tétraalkylammonium)
CH3N(CH2CH3)2
+ C2H5I → [CH3N(CH2CH3)3]⁺ I⁻
Ces
alkylations sont successives si les proportions de l’halogénure d’alkyle sont
excessives. La réaction s’arrête au niveau désiré en contrôlant les réactifs
EXERCICES
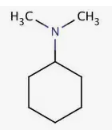
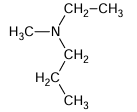
EXERCICE I : Nomme les amines suivantes :
a)
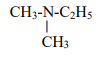
b) CH3-NH-CH2-C2H5
c)
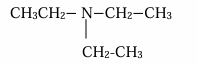
d)
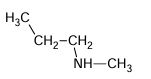
e)
EXERCICE II: Écris la formule semi-développée
des amines suivantes :
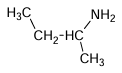
a) butan-2-amine
b) N-méthyléthanamine
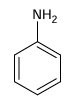
c) phenylamine
d) 3-methyl-1-phenylamine
e) 1 ,1-diméthyléthylamine
EXERCICE III.
Une amine de formule brute C4H11N
:
1. Écris les
formules semi-développées possibles ;
2. Nomme-les, puis précise leur classe.
EXERCICE IV :
Des
amines primaires saturées et non cycliques contiennent n atomes de carbone.
1.
Donner leur formule brute en fonction de n.
2.
Une masse de 15 g de l’une de ces amines contient 2,9 g d’azote.
Déterminer
sa formule brute, ainsi que les formules semi-développées de tous ses isomères
possibles.
EXERCICE V :
Une
amine tertiaire contient une masse de 66% de carbone, 15% d’hydrogène et 19%
d’azote.
1.
Déterminer sa masse molaire.
2.
Donner sa formule brute, sa formule semi-développée ainsi que son nom.
3.
Quelle est la masse du produit obtenu lorsqu’on fait réagir 0,73 g de l’amine
sur 1,56 g d’iodoéthane, en supposant la réaction
totale.
EXERCICE VI :
Une
amine a pour formule brute ; C8H11N.
1.
Donner les formules semi-développées et les noms de tous ses isomères amines.
2.
Identifier les formules des isomères aromatiques.
3.
L’amine précédente réagit sur l’iodoéthane pour
donner un seul produit. Donner la formule et le nom de cet amine et du produit
formé.
EXERCICE VII :
Une amine tertiaire A réagi sur l’iodo-1-butane
en solution dans l’éther, pour donner un précipité blanc qui est un solide
ionique.
1.
Ecrire l’équation bilan de la réaction.
2.
Quelle est la propriété des amines que cette réaction met en évidence ?
3.
Une solution de l’amine A, de concentration C=0,2 mol.l-1,
est obtenue par dissolution de 20,2 g d’amine pour 1l de solution. En déduire
sa masse molaire, sa formule brute, sa formule semi-développée et son nom.
EXERCICE VII :
La masse molaire d’une amine saturée non
cyclique est de 59 g/mol.
1.
Déterminer la formule brute de cette amine.
2.
Donner les formules développées possibles, les noms et les classes des amines
correspondantes.
3.
Ecrire l’équation de la réaction de l’une des amines avec l’eau. Quels
caractères des amines cette réaction met – elle en jeu
4.
Une de ces amines réagit avec l’iodure d’éthane en donnant un seul produit.
Ecrire l’équation bilan de cette réaction et nommer le produit obtenu. Quel
caractère des amines cette réaction met-elle en jeu ? Le définir.
Données ; O : 16 ; N : 14 ; H :1
CORRIGES
EXERCICE I :
a) N, N-diméthyléthanamine
b) N-méthylpropanamine
c)
![]()
d)
![]()
e)
![]()
EXERCICE
II :
a)
b)
CH3−NH−CH2−CH3
c)
d)
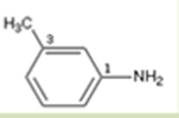
e)
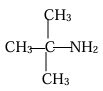
EXERCICE III :
1. Formules semi-développées
a) CH3CH2CH2CH2NH2: Butanamine;
b)
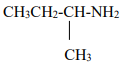 Méthylpropanamine
Méthylpropanamine
c)
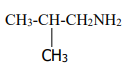 2-méthylpropananime
2-méthylpropananime
d)
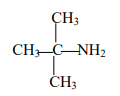 :1,1-diméthyléthylamine
:1,1-diméthyléthylamine
e) ( C2H5)2NH2
: Diéthylamine
f) : N-méthylpropanamine
g) C2H5N(CH3)2
: N,N-diméthyléthylamine
2. Les classes des amines :
Amines primaires : a ,
b , c , et d
Amines secondaires : e et f
Amine tertiaire : g
EXERCICE IV :
1. CnH2n+1
NH2.
2. M=12n+2n+1+2+14=14n+17
%N=(2,9/15)
x100=14/(14n+17)x100 <= >n≈4 => C4H11
N
CH3─CH2─CH2─CH2─NH2
butylamine
CH3─CH2─CH
─CH3
│
NH2
butan-2-amine
CH3─
N ─CH2─CH3
│
CH3
N,N-dimethylethylamine
CH3─CH2─NH─CH2─NH2
diethylamine
CH3─CH2─CH2─NH
─CH3
N-methylpropylamine
EXERCICE V :
L’amine a pour formule : CxHy N
1. ![]()
![]()
2.
![]()
![]()
![]()
![]()
Formule brute : C4H11
N
Formule semi-développée :
CH3─ N ─CH2─CH3
│
CH3
N-dimethylethylamine
Nom: trimetylamine
3. C2H5
│
CH3─
N ─CH2─CH3
+ C2H5 I ![]() CH3─ N+ ─CH2─CH3 +I-
CH3─ N+ ─CH2─CH3 +I-
│
│
CH3
CH3
1mol 1mol 1mol
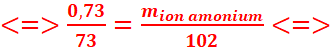
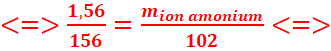
![]()

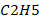
![]()
EXERCICE
VI :
Une amine tertiaire A
réagi sur l’iodo-1butane en solution dans l’éther, pour donner un précipité
blanc qui est un solide ionique.
1. R1R2R3N
+ C4H11I ![]() R1R2R3
R1R2R3
2. Cette réaction met en évidence le caractère
nucléophile des amines
3.
.CnH2n+3
N.
M=12n+2n+3+14=14n+17
C=n/V=m/MV=>M=m/CV=20,2/0.2x1=101g/mol.
14n+17=101 => n=(101-17)/14=6.
Formule brute : C6H15
N
Formule semi-développée : (C2H5)3-N
Nom : triéthylamine
EXERCICE
VI :
1. CnH2n+3 N. M=14n+17=59=>n=(59-17)/13=3.
C3H9
N.
2. Formules développées possibles, les noms
et les classes des amines correspondantes.
![]()
![]() propanamine ; amine primaire
propanamine ; amine primaire
![]()
![]() propa-2-amine ; amine primaire
propa-2-amine ; amine primaire
![]()
![]() : N-metylethylamine
ou N-metylethanamine ; amine secondaire.
: N-metylethylamine
ou N-metylethanamine ; amine secondaire.
![]() (CH3)3N
: trimethylamine; amine tertiaire
(CH3)3N
: trimethylamine; amine tertiaire
3 Equation de la réaction de l’une des
amines avec l’eau.
![]()
![]()
![]()
![]() +H
+H![]()
Caractère basique des amines : c’est une
base faible
4.
CH3
│
![]() (CH3)3N
+C2H5I ⇀ CH3─N+─C2H5 + I-
(CH3)3N
+C2H5I ⇀ CH3─N+─C2H5 + I-
│
CH3
ethyltrimetylammonium
Cette réaction met en jeu le
caractère nucléophile des amines.
Avez-vous
un exercice à proposer ?Cliquez-ici
Merci de votre visite
Laissez un commentaire