LES MOLECULES ET LES IONS
LES IONS
Définition
Un ion est un atome (ou groupe d’atomes), ayant perdu
(ou gagné) un (ou plusieurs) électrons.
·
Un atome qui a perdu un ou plusieurs
électrons est un ion positif ou cation.
Exemples : Na+ ; K+ ; Ca2+
·
Un atome qui a gagné un ou plusieurs
électrons est un ion négatif ou anion.
Exemples : Cl- ; I- ; O2-
Ions monoatomiques
Ils sont constitués d’un seul atome.
Exemples :H+ ; Cl- ; Al3+
Les ions monoatomiques sont, comme les atomes, des
représentants des éléments.
Ions polyatomiques
Il existe des ions formés des ions à
partir de plusieurs atomes. Ils sont des ions polyatomiques.
Exemple : H3O+ ; SO42-
Remarques :
Les éléments dont les atomes ont tendance à perdre des
électrons pour devenir des ions positifs sont dits électropositifs.
Les éléments dont les atomes ont tendance à gagner des
électrons pour devenir des ions négatifs sont dits électronégatifs.
LES MOLECULES
Définition
Une molécule est un assemblage,
électriquement neutre, formé des atomes liés entre eux.
Une molécule peut être monoatomique (formée d’un seul type d’atome).
Exemples : H2 ; O2
Une molécule peut être polyatomique (formée de plusieurs types d’atomes).
Exemples : H2 ; NH3
La liaison entre deux atomes d’une molécule est
appelée liaison covalente.
L’atomicité
d’une molécule est le nombre d’atomes qu’elle contient.
Représentation d’une
molécule
- La formule brute d’une molécule est obtenue par juxtaposition des
symboles des éléments constituant cette molécule. Chaque symbole porte en
indice, en bas et à droite, le nombre d’atomes de cet élément dans la
molécule. Le nombre 1 n’est pas porté.
Exemple :
H2O : cette
molécule d’eau est constituée de 2 atomes d’hydrogène(H) et 1 atome
d’oxygène(O) ;
HCl :
cette molécule d’acide chlorhydrique (ou chlorure d’hydrogène) est constituée
de 1 atome d’hydrogène(H) et 1 atome de Chlore (Cl);
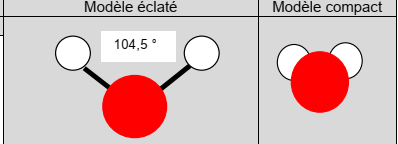
- Une molécule peut aussi être
représentée par des modèles
moléculaires.
Les atomes
sont modélisés par des billes dont la couleur est associée à un élément
chimique.
Étant
donné que la plupart des molécules complexes sont organiques, il a été choisi
d’attribuer
une
couleur aux principaux éléments de ce type de substance, à savoir au carbone, à
l’hydrogène,
à
l’oxygène, à l’azote, au chlore et au soufre. Par convention, les couleurs sont
les suivantes :


Exemple de la molécule d’eau
EXERCICES
EXERCICE I :
Recopie et complète les phrases
suivantes :
1. Une ……………….est un assemblage bien ordonné d’atomes
liés entre eux.
2. Lorsqu’une molécule est constituée d’un seul type
d’atomes, c’est une molécule ……………
3. La liaison entre deux atomes d’une molécule est
appelée liaison ……………….
4. La…………….d’une molécule s’écrit en utilisant les
symboles des atomes qui la constituent avec en indice le nombre
de chaque atome.
5. Une molécule peut aussi être représentée par
des………………..
EXERCICE II : Recopie et
complète les phrases suivantes :
1. Un…………………..est un atome ou un………………d’atomes ayant
gagné ou perdu un ou plusieurs électrons.
2. Un……………..est un ion négatif c.-à-d. un atome ou une
molécule ayant………………..au moins un ………………..
3. Un cation est un ion ……………c.-à-d. un atome ou une molécule ayant………………..au
moins un ……………………
4. Lorsqu’un atome simple a perdu ou gagné un ou
plusieurs électrons, c’est un ion……………..
5. Lorsqu’un groupe d’atome a perdu ou gagné un ou
plusieurs électrons, c’est un ion……………..
EXERCICE III :
Ecris les formules des corps suivants :
Dioxyde de carbone, eau, dioxygène, dihydrogène,
dioxyde de soufre, Aluminium, Ozone,
Monoxyde de carbone.
EXERCICE IV :
1. Quels sont les ions issus des atomes ou groupe d’atomes suivants : Cu, Al, Cl, OH, Mg,
SO4
2. Complete le tableau suivant :
|
Nom de l’ion |
Symbole de l’ion |
Nature de l’ion |
Type d’ions |
|
………… |
Ca2+ |
…………. |
…………. |
|
Ion
sulfate |
|
Cation |
|
|
Ion
aluminium |
…………. |
…………. |
Monoatomique
|
|
|
H3O+ |
……….. |
…………. |
|
Ion
chlorure |
…………. |
anion |
………….. |
|
Ion
hydroxyde |
………… |
…………. |
Polyatomique
|
SOLUTIONS :
EXERCICE I :
Recopie et complète les
phrases suivantes :
1. Une molécule est un assemblage
bien ordonné d’atomes liés entre eux.
2. Lorsqu’une molécule est constituée d’un
seul type d’atomes, c’est une molécule monoatomique
3. La liaison entre deux atomes d’une
molécule est appelée liaison covalente.
4. La formule brute d’une molécule s’écrit
en utilisant les symboles des atomes qui la constituent avec en indice le
nombre de chaque atome.
5. Une molécule peut aussi être représentée
par des modèles moléculaires.
EXERCICE II : Recopie
et complète les phrases suivantes :
1. Un ion est un atome ou un groupe
d’atomes ayant gagné ou perdu un ou plusieurs électrons.
2. Un anion est un ion négatif
c.-à-d. un atome ou une molécule ayant gagné au moins un électron.
3. Un cation est un ion positif
c.-à-d. un atome ou une molécule ayant
perdu au moins un électron.
4. Lorsqu’un atome simple a perdu ou gagné
un ou plusieurs électrons, c’est un ion monoatomique.
5. Lorsqu’un groupe d’atome a perdu ou gagné
un ou plusieurs électrons, c’est un ion polyatomique.
EXERCICE III :
Dioxyde de carbone : CO2,
Eau : H2O,
Dioxygène : O2,
Dihydrogène : H2,
Dioxyde de soufre : SO2,
Aluminium : Al,
Ozone :O3
Monoxyde de carbone : CO.
EXERCICE IV :
1.
Cu : Cu++,
Al : Al+++,
Cl : Cl-,
OH: OH-,
Mg: Mg++,
SO4: SO42-
2.
|
Nom de l’ion |
Symbole de l’ion |
Nature de l’ion |
Type d’ions |
|
Ion calcium |
Ca2+ |
cation |
Monoatomique |
|
Ion sulfate |
SO4-- |
anion |
Polyatomique |
|
Ion aluminium |
Al+++ |
cation |
Monoatomique |
|
Ion hydronium |
H3O+ |
cation |
Polyatomique |
|
Ion chlorure |
Cl- |
anion |
Monoatomique |
|
Ion hydroxyde |
OH- |
anion |
Polyatomique |