CLASSIFICATION PERIODIQUE DES ELEMENTS
NOTION D’ELEMENT CHIMIQUE
Tous les corps sont
constitués d’éléments chimiques. Il existe 118 éléments chimiques connus dont 3
sont en attente de confirmation, 25 artificiels et 93 naturels, à partir
desquels sont constitués tous les corps existants. La combinaison des éléments
chimiques peut donner une infinité de corps différents.
Définition
L’élément chimique est
un corps commun à plusieurs autres corps.
Exemple :
·
Le
carbone est commun au pétrole, butane, alcool, bougie,
·
Le
cuivre est commun au métal cuivre, à l’oxyde de cuivre II et à l’ion cuivre.
Symboles des éléments chimiques
Les éléments sont
représentés par des symboles. Le symbole d’un élément est toujours une lettre
majuscule, la première du nom français ou étranger, suivie quelquefois d’une
seconde lettre minuscule pour différenciation.
Exemples :
|
Nom
de l’élément |
Symbole
de l’élément |
|
Carbone Hydrogène Fer Cuivre Azote Chlore Soufre |
C H Fe Cu N Cl S |
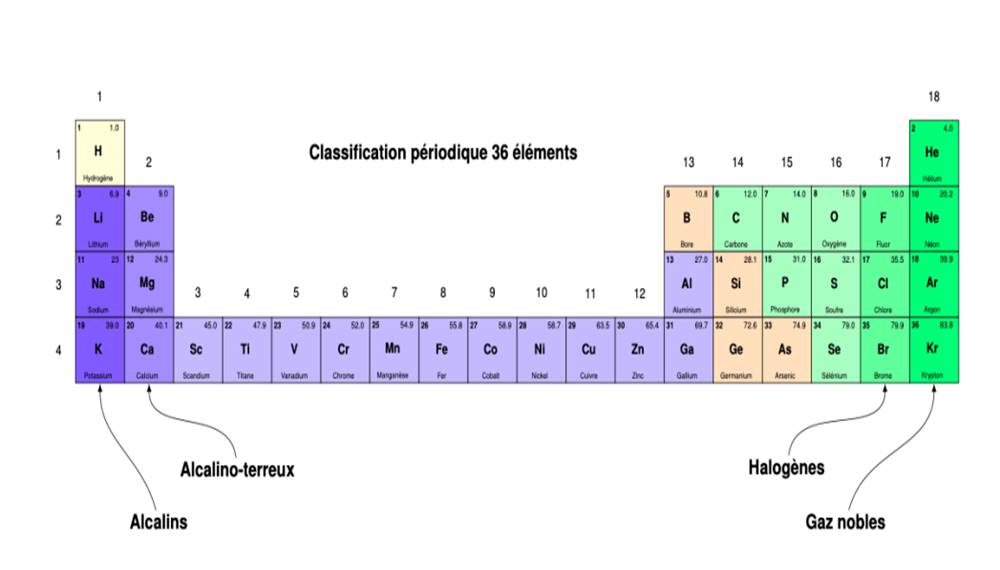
CLASSIFICATION PERIODIQUE DES ELEMENTS
Tous les éléments sont groupés dans un tableau qui est le
tableau de classification périodique des
éléments.
Principe de classification :
Les éléments,
représentés par leurs symboles, sont classés par ordre de numéro atomique
croissant dans un tableau à 18 colonnes
ou groupes et 7 lignes ou périodes.
Chaque élément occupe une case du tableau. Son numéro atomique est situé en
haut et à gauche de la case.
Chaque
période correspond au remplissage d’une couche électronique. Ainsi, la première
période correspond au remplissage de la couche K, la seconde celle de la couche
L…Lorsqu’une couche est remplie, on passe à la période suivante, de sorte que
tous les éléments d’une même colonne possèdent le même nombre d’électrons
périphériques.
Exemples :
-Le groupe de la colonne I est le groupe des
alcalins : les atomes de ces éléments possèdent un électron périphérique.
A l’exception de l’hydrogène, ce sont les alcalins (lithium, sodium,
potassium…)
-Le groupe de la colonne 17 est le groupe des allogènes :
les atomes de ces éléments ont 7 électrons périphériques (fluor, chlore, brome,
iode…)
-Le groupe de la colonne 18 est le groupe des gaz
rares : les gaz rares ou gaz nobles n’interviennent pas dans les
réactions chimiques car leur couche externe est saturée mis à part l’hélium. On
dit qu’ils possèdent une grande inertie chimique (hélium, néon, argon,
krypton).
Différentes familles d’éléments.
a. Les alcalins.
. Première colonne de la
classification, ils possèdent tous un seul électron sur la couche externe.
Ils ont tendance à facilement perdre cet électron (en vertu de la règle de
l’octet) et devenir des cations avec une charge positive.
A l’exception de l’hydrogène, les éléments de la première colonne appartiennent
à la famille des alcalins. Dans la nature on les rencontre sous forme d’ions Li+
(ion lithium), Na+ (ion sodium) ou K+ (ion potassium),
comme dans l’eau ou les eaux minérales. Ils sont responsables du goût salé. A
l’état de corps purs simples ce sont des métaux mous qui réagissent
spontanément avec le dioxygène de l’air ou l’eau.
b. Les alcalino-terreux.
. Deuxième colonne de la
classification, ils possèdent deux électrons sur la couche externe, électrons
qu’ils ont facilement tendance à perdre pour donner des cations avec deux
charges positives.
c. Les halogènes.
. Dans la 17ème colonne,
ils possèdent sept électrons sur la dernière couche. Ils ont tendance à gagner
un électron pour donner un anion avec une charge négative.
Les éléments de la 17ème colonne (7ème colonne de la classification simplifiée)
appartiennent à la famille des halogènes.
Dans la nature, on les rencontre sous forme d’ions monoatomiques : F-
(ion fluorure) ; Cl- (ion chlorure) ; Br- (ion bromure).
Ils peuvent également exister sous forme de molécules diatomiques : F2 , Cl2, Br2
.
Ces espèces chimiques sont fortement colorées et très nocives.
d. Les gaz nobles.
Appartenant à la dernière
colonne, ils possèdent déjà huit électrons sur la couche externe : ils sont
donc naturellement stables.
Les gaz rares sont peu présents dans l’atmosphère terrestre. Ce sont les
éléments chimiques les plus stables. Ils sont inertes chimiquement c’est-à-dire
qu’ils ne participent à aucune réaction chimique. Ils ne forment pas d’ions ni
de molécules.
L’hélium est l’élément le plus abondant dans l’Univers après l’hydrogène.
Intérêt de la classification périodique des éléments Intérêt de de
la classification
·
Elle fournit des renseignements importants sur
chaque élément chimique :
-son symbole X
-son numéro atomique Z
-sa masse atomique.
·
Les atomes des éléments d’une même colonne ont,
le même nombre d’électrons périphériques. Ils ont les propriétés chimiques
semblables et forment un groupe ou famille.

Numéro atomique
Z =8
Masse atomique=16
EXERCICES
EXERCICE
I :
En vue d’identifier les éléments
chimiques contenus dans le saccharose (sucre), on fait chauffer du sucre en
vase clos.
À l’issu
du chauffage, il se forme du « charbon de sucre » et de la vapeur d’eau.
On demande
d’interpréter ces résultats.
1) Définis
l’élément chimique.
2) Nomme
les éléments chimiques contenus dans le charbon et dans la vapeur d’eau.
3) Déduis
des produits de la réaction chimique, les éléments chimiques contenus dans le
saccharose.
EXERCICE II: Complète le tableau suivant à l’aide des
renseignements que tu retrouveras dans la case occupée par chacun des
éléments :
|
Nom de
l’élément |
|
Carbone |
Azote |
Chlore |
|
Calcium |
|
Symbole |
|
C |
|
Cl |
|
Ca |
|
Numéro
atomique (Z) |
2 |
|
|
|
13 |
|
|
Masse molaire atomique
(g.mol-1) |
|
|
14.0 |
|
|
|
EXERCICE III : L’élément sodium a pour
numéro atomique Z=11
A partir du tableau de classification périodique des
éléments, réponds aux questions suivantes :
1. Quel est son symbole ?
2. Situe-le dans le tableau de classification
simplifié.
3. Quels sont le numéro atomique, le nom, le symbole
et la situation dans le tableau simplifié de :
a) L’élément situé directement au-dessus de sa
case ?
b) L’élément situé directement en-dessous de sa
case ?
c) L’élément situé à deux cases avant la sienne ?
d) L’élément qui le suit dans le tableau ?
4. Quelle
est la masse molaire atomique de l’élément sodium.
EXERCICE IV:
Soient les atomes suivants : C(Z=6),
P(Z=15), O(Z=16),Cl(Z=17), F(Z=9).
Donner la localisation de ces éléments dans le tableau périodique (indiquer le
groupe et la période), précisez les électrons de valence, ainsi que le nombre
d’électrons célibataires.
CORRIGES :
EXERCICE
I :
1) L’élément chimique est ce qui
est commun à un corps simple et à tous ses composés.
2)
Éléments chimiques :
-
Dans le charbon : élément carbone
-
Dans la vapeur d’eau : élément hydrogène et élément oxygène.
3)
Éléments chimiques dans le saccharose
Élément
carbone, élément hydrogène et élément oxygène
EXERCICE II : Complète le
tableau suivant à l’aide des renseignements que tu retrouveras dans la case
occupée par chacun des éléments :
|
Nom de l’élément |
Hélium |
Carbone |
Azote |
Chlore |
Aluminium |
Calcium |
|
Symbole |
He |
C |
N |
Cl |
Al |
Ca |
|
Numéro atomique (Z) |
2 |
6 |
7 |
17 |
13 |
20 |
|
Masse molaire atomique (g.mol-1) |
4.0 |
12.0 |
14.0 |
35,5 |
27 |
40,1 |
EXERCICE III : L’élément sodium a
pour numéro atomique Z=11
1. Na
2. 1ère colonne,3ème
ligne.
3.
a) L’élément situé directement au-dessus de
sa case ?
Numéro atomique :3
Nom: Lithium
Symbole :Li
Situation :1ère colnne,2ème
ligne.
b) L’élément situé directement en-dessous de
sa case ?
Numéro atomique :19
Nom:Potassium
Symbole :K
Situation :1ère colonne ,4ème
ligne.
c) L’élément situé à deux cases avant la sienne
?
Numéro atomique :9
Nom:Fluor
Symbole :F
Situation :17ème colonne ,2ème
ligne.
d) L’élément qui le suit dans le
tableau ?
Numéro atomique :12
Nom: Magnésium
Symbole : Mg
Situation :2ème colonne,3ème
ligne.
4.
masse molaire atomique de l’élément sodium : 23.0
EXERCICE IV:
|
Atomes |
Groupe |
Période |
Nombre électrons de valence (Périphériques) |
Nombre électrons célibataires |
|
C (Z=6), |
14 |
2 |
4 |
4 |
|
P(Z=15), |
15 |
3 |
5 |
3 |
|
O(Z=8) |
16 |
3 |
6 |
2 |
|
Cl(Z=17), |
17 |
3 |
7 |
1 |
Avez-vous
un exercice a proposer?Cliquez-ici
Merci de votre visite
Laissez un commentaire