ALDÉHYDES ET CÉTONES
DÉFINITIONS
Un composé carbonylé est
un composé organique oxygéné comportant le groupe carbonyle :
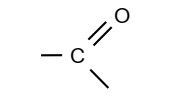
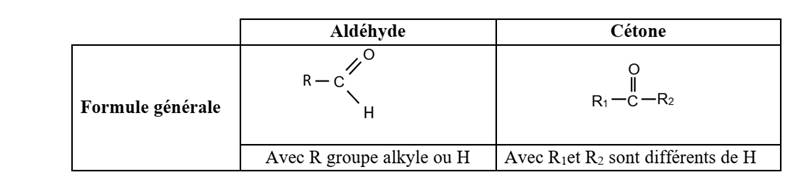
Un aldéhyde est un composé carbonylé dont l’atome de carbone du groupe
carbonyle est lié à un atome d’hydrogène.
Une cétone est un composé carbonylé dont l’atome de carbone du
groupe carbonyle est lié à deux atomes de carbone tétragonaux.
Formule brute générale : CnH2nO, où
n est le nombre d’atomes de carbone.
NOMENCLATURE
Nomenclature
des aldéhydes
Le nom d’un aldéhyde s’obtient en remplaçant le
« e » final du nom de l’alcane dont il dérive par le suffixe
« al ». Dans les aldéhydes, le groupe carbonyle est toujours situe en
bout de chaine ; il est inutile de préciser la position du carbone
fonctionnelle revanche, la position des éventuels substituants est aussi
précisée en numérotant la chaine carbonée (la plus longue) à partir du carbone
fonctionnel du groupe aldéhyde.
Exemple :
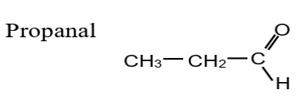
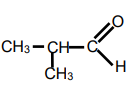
2-methylpropanal
Nomenclature
des cétones
Le nom d’une cétone s’obtient en remplaçant le
« e » final du nom de l’alcane dont il dérive par le suffixe
« one », précédé d’un indice précisant la position du carbone
fonctionnel dans la chaine carbone principale (la plus longue), est numérotée
de façon à attribuer au carbone fonctionnel le plus petit indice possible.
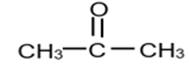
Exemple :
Propan-2-one ou Propanone
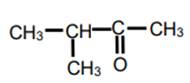
3-méthylbutan-2-one
PROPRIÉTÉS
CHIMIQUES
Les aldéhydes et les cétones possèdent une propriété
commune : l’action sur la 2,4-dinitrophenylhydrazine(2,4-D.N.P.H).
Contrairement aux cétones, les aldéhydes peuvent subir l’oxydation ménagée, ce
qui leur confère un caractère réducteur.
Propriété
commune (Test commun) : test à la Dinitrophénylhdrazine
En
présence d’un composé carbonylé (aldéhyde et cétone),
la 2,4-dinitrophénylhydrazine (2,4-DNPH)
donne un précipité jaune-orangé.

Propriétés
spécifiques aux aldéhydes
Test au réactif de Schiff
En
présence d’un aldéhyde, le
réactif de
Schiff (incolore) vire
au rose.

Propriétés réductrices des
aldéhydes
Test au nitrate d’argent
ammoniacal (ou réactif de Tollens)
Les
aldéhydes réduisent le réactif de Tollens.
Au cours cette
réaction, en milieu basique, l’aldéhyde est oxydé
en ion
carboxylate et l’ion diamine argent I (présent dans le
réactif de
Tollens) est réduit en argent métallique.

L’équation-bilan de cette oxydo-réduction s’écrit :
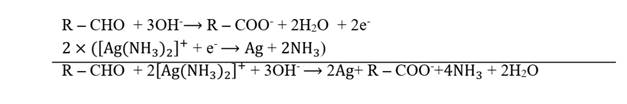
Réduction de la liqueur de Fehling
Les
aldéhydes réduisent la liqueur de
Fehling.
Au cours de
cette réaction, les ions
cuivre II (présent
dans la liqueur de
Fehling) sont
réduits en oxyde de
cuivre I et
l’aldéhyde est oxydé en ion
carboxylate.
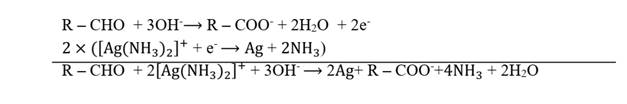
L’équation-bilan de cette oxydo-réduction s’écrit
:
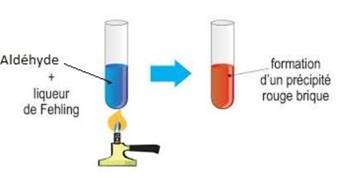
Conclusion
·
Le dépôt d’argent avec le réactif de Tollens et la formation du précipité
rouge brique avec la liqueur de Fehling met en évidence la présence du groupe
aldéhyde.
·
Les aldéhydes sont des réducteurs, ce qui n’est pas le cas des cétones.
|
|
2,4-DNPH |
Réactif de Schift |
Réactif de Tollens |
Liqueur de Fehling |
|
Aldéhyde |
Précipité jaune |
Coloration rose |
Formation du miroir d’argent |
Précipité rouge brique de Cu2O |
|
Cétone |
Précipité jaune |
Rien |
Rien |
Rien |
EXERCICES
EXERCICE I :
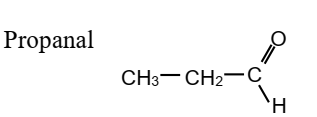
1.
Une solution contient du propanal et de la propanone.
Comment pourrait-on mettre en évidence chacun des deux composés ?
2.
Un composé de formule C3H6O donne un précipité jaune avec
la 2,4-D.N.P.H, mais ne réagit pas avec le réactif de Tollens. En déduire la
formule semi-développée et le nom de ce composé.
3.
Un composé A présente les propriétés suivantes : A rosit le réactif de
Schiff et donne un précipité jaune avec la 2,4-D.N.P.H. D’autre part, 1 g de A
traité avec un excès de l’ion complexe Ag (NH3)2+
donne un dépôt de 3,72 g d’argent. En déduire la formule de A.
EXERCICE II :
Tu disposes
d’un composé carbonylé A de formule brute C2H4O.
1. Donne :
1.1. La fonction
chimique et le groupe fonctionnel de A ;
1.2. La formule
semi-développée et le nom de A ;
2. Précise ce qu’on observe quand on fait réagir A
avec :
2.1. Une solution de 2,4-DNPH ;
2.2. Le réactif de
Tollens.
3. Écris l’équation-bilan de la réaction du composé
A avec la liqueur de Fehling (Cu2O/Cu2+)
EXERCICE III :
Au laboratoire de Physique-Chimie de ton
établissement scolaire, se trouve une bouteille d’alcool saturé A qui porte la
mention unique suivante : densité de vapeur par rapport à l’air d = 2,07. Le
professeur te demande de définir cet alcool et le produit B de son oxydation
ménagée en milieu acide par les ions dichromates Cr2O7 2−
, sachant que B réagit avec la 2,4-D.N.P.H et possède des propriétés
réductrices.
1. Donne la formule générale d’un alcool saturé dont
la formule renferme n atomes de carbone.
2. Montre que
la formule brute de l’alcool A est C3H8O.
3. Détermine la fonction chimique de B.
4. Déduis-en les formules semi-développées et les
noms de A et B.
Données : C :
12 gmol−1 ; O : 16 gmol−1 ; H : 1 gmol−1
EXERCICE IV :
La combustion complète de 0,770 g d’une
substance organique formé du carbone, d’hydrogène et d’oxygène donne 0,630g
d’eau et 1,54g de dioxyde de carbone.
1.
Quelle est la composition centésimale de cette substance ?
2.
Quelle est sa formule brute, sachant que sa densité de vapeur par rapport à
l’air est voisine de 1,5 ?
3.
Déterminer la formule développée de cette substance sachant qu’elle donne un
précipité jaune avec la 2,4-D.N.P.H. et qu’elle réduit la liqueur de Fehling.
EXERCICE V :
69 g d’éthanol est traité de façon à obtenir de
l’éthanal.
1.
Quelle masse maximale peut-on espérer obtenir ?
2.
On prélève 1/100 du liquide obtenu et on traite par la liqueur de Fehling. Le
précipité rouge obtenu, lavé et séché, pèse 1,27g.
Quel
a été le rendement de la transformation de l’éthanol en éthanal.
CORRIGES:
EXERCICE
I :
1. Mise en évidence de chacun des deux composés
Utiliser
-soit le Réactif de Schiff qui donne une coloration rose avec le propanal et rien avec la propanone.
-soit le Réactif de Tollens qui donne la formation d’un miroir
d’argent avec le propanal et rien avec la propanone.
-soit la Liqueur de Fehling qui donne un Précipité rouge brique de
Cu2O avec le propanal et rien avec la
propanone.
2. Il s’agit de la formule propanone.
Formule semi-développée :
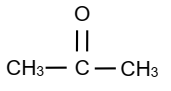
3. Le composé A est un aldéhyde de formule générale : CnH2nO.
Sa masse molaire est M=12n+2n+16=14n+16
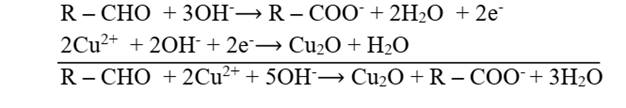
Soient nA, nombre de moles de A
et nAg, nombre de moles de Ag.
![]() <=>
<=>![]() =>n=3 =>C3H6O
=>n=3 =>C3H6O
EXERCICE II :
1. Donnons :
1.1. Fonction chimique : Aldéhyde ; groupe
fonctionnel : -CHO ou
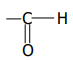
1.2. Formule semi-développée :
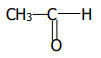
2. 2.1. Précipité jaune
2.2. Miroir d’argent ou dépôt d’argent
3. Équation-bilan avec la liqueur de
Fehling
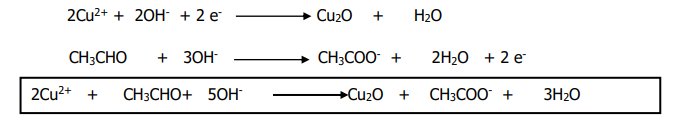
EXERCICE III :
Formule générale d’un alcool saturé CnH2n+1OH
ou CnH2(n+1)O
2. Formule brute de l’alcool
La
masse molaire de A est MA = 29d = 60 gmol−1
MA = (12n + 2n + 2 + 16 )/60 = 14 n + 18 n = 3 D’où la formule brute C3H8O .
3. La fonction chimique de B. B réagit
avec la 2,4-D.N.P.H et possède des propriétés réductrices ; B est un aldéhyde.
4. Les formules semi-développées et les
noms de A et B.

Puisque B est un aldéhyde, alors A est l’alcool primaire de formule CH3 −
CH2 − CH2 − OH nommé propan-1-ol.
B
est le Propanal E
EXERCICE IV :
2.1. Composition centésimale
de cette substance
%C=(mc/m) x100 or mC =(12x1,54) /44=0,42 => %C=
(0,42/0.770) x100=54,54% // tout
le carbone de la substance est contenu dans le CO2.
%H=(mH/18) x100 or mH =(2x0,630) /18=0,07 => %H=
(0,07/0.770) = x100=9,09% // tout
l’hydrogène de la substance est contenu dans le H2O.
%O=100-(54,54+9,09) = 36,36%
2.2. Formule brute,
M=29d=29x1,5=43,5g mol-1
14n+16=43,5 => n![]() 2 =>C2H4O
2 =>C2H4O
2.3. Formule développée :
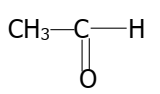
.
EXERCICE V :
1. l’oxydation de l’éthanol au contact du cuivre chaud donne de l’éthanal
selon l’équation :
CH3-CH2-OH +1/2O2→CH3-CHO
+H2O
La réaction se fait mole a mole en présence du CuCH3-CHO
![]() =
=![]()
![]()
2. L’équation bilan avec la liqueur de Fehling est :
CH3-CH2-OH +2Cu2+
+5HO- →Cu2O + CH3-COO- +3H2O
![]() =
=![]()
![]() =
=![]()
![]()
![]()
Avez-vous
un exercice à proposer ?Cliquez-ici
Merci de votre visite
Laissez un commentaire