STRUCTURE
ELECTRONIQUE DES ATOMES
CARACTERISTIQUES
DE L’ELECTRON
L’électron a une charge négative
égale, en valeur absolue, à la charge élémentaire.
Charge de l’électron : qe= -e = -1,6.10-19 C
Masse de l’électron : me=9,1.10-31kg
L’atome étant électriquement neutre,
la charge d’un proton étant, en valeur absolue égale à la charge d’un électron,
il en résulte que :
-dans un atome, le nombre
d’électrons est égal au nombre de protons. (la charge négative des électrons est compensée par la charge positive du
noyau)
-la masse d’un atome est
pratiquement celle de son noyau.
REPARTITION DES ELECTRONS AUTOUR DU NOYAU
Remplissage des couches
D’une manière générale, les électrons sont repartis
sous forme de couches. Appartiennent à la même couche les électrons qui sont,
en moyenne, à la même distance du noyau. Elles sont désignées par un nombre
appelé nombre quantique n.
On peut également désigner les
couches par les lettres K, L, M, N, O, P, Q
· Une couche ne peut contenir qu’un nombre limité
d’électrons. Le nombre maximal d’électrons pouvant appartenir à une couche de
nombre quantique n est 2n2.
· Les électrons remplissent les couches en suivant
l’ordre croissant des nombres quantiques :
-d’abord la couche K, puis la couche
L…
-une couche ne commence à se remplir
que lorsque la couche précédente est saturée.
Formule électronique
La structure électronique d’un
atome est représentée par une formule
électronique dans laquelle les couches électroniques sont représentées par
des lettres portant en exposant le nombre d’électrons contenus dans la couche
correspondante.
Exemple : formule électronique du magnésium de numéro atomique
Z=12
La première couche K est saturée à 2
électrons, on écrit K2
Puis la couche L est saturée à 8
électrons, on écrit L8
Il reste 2 électrons pour la couche
M, on écrit M2
La formule électronique du magnésium
est : K2L8M2
Remarque :
En fait, les règles de remplissage ne
s’appliquent rigoureusement que jusqu’à l’argon (Z=18). A partir du
potassium (Z=19), la couche N commence à se remplir alors que la couche M ne
renferme que 8 électrons.
STRUCTURE DE LEWIS
Les électrons de la couche la plus
éloignée du noyau ou couche externe ont une grande importance. Ces électrons
appelés électrons périphériques ou
électrons de valence sont
responsables des propriétés chimiques des éléments.
Les électrons périphériques
peuvent :
-soit être groupés par deux pour
former des doublets d’électrons.
- soit rester seuls, ils sont dits
alors électrons célibataires ou non appariés.
Il est important de connaître le
nombre d’électrons célibataires d’un atome car ils permettent d’expliquer les propriétés chimiques.
La représentation de Lewis permet de
mettre en évidence les électrons de la couche externe. Les électrons
célibataires seront représentés par un point(.), les doublets par un tiret (-),
placés autour du symbole de l’élément considéré.
Exemple :
l’atome de soufre(Z=16) pour formule électronique K2L8M6
Sa représentation de Lewis est
:

On observe deux doublets et deux
électrons célibataires.
FORMATION DES IONS MONATOMIQUES
Définition
Un ion est un atome (ou groupe
d’atomes), ayant perdu (ou gagné) un (ou plusieurs) électrons.
Règle de
l’octet
Au cours de leurs
transformations, les atomes tendent à saturer leur couche externe à 8 électrons
(1 octet), exception faite de l’hydrogène qui sature la sienne à 2 électrons (1
doublet).
La formule électronique de l’atome
de sodium est K2L8M1. D’après la règle de l’octet,
cet atome tend à acquérir une couche externe à 8 électrons, donc à perdre
l’unique électron de la couche M, la couche L devenant, de ce fait, la couche
externe
L’atome
de sodium, ayant perdu un électron, se charge positivement car il possède un
proton en excédent. Il devient l’ion sodium, noté Na+
On
traduit cette transformation par une équation électronique. :
Na → Na+ + e-
La
formule électronique de l’atome de chlore est K2L8M7.
Pour obéir à la règle de l’octet, l’atome de chlore a tendance à capter un
électron pour porter la couche M à 8 électrons. Il se charge alors négativement
car il possède un électron en excédent. Il devient l’ion chlorure Cl -
On
traduit cette transformation par une équation électronique. :
Cl +e- → Cl-
Au
cours de la formation de chlorure de sodium, les atomes de sodium ont cédé des
électrons aux atomes de chlore. Les atomes se sont transformés en ions, espèces
chimiques stables.
Les ions monoatomiques sont, comme les atomes,
des représentants des éléments.
Remarque :
Les éléments dont les atomes ont
tendance à perdre des électrons pour devenir des ions positifs sont dits électropositifs.
Les éléments dont les atomes ont tendance à
gagner des électrons pour devenir des ions négatifs sont dits électronégatifs.
Existence des
ions polyatomiques
Il
existe des ions formés à partir de plusieurs atomes. Ils sont des ions
polyatomiques : SO42-, H3O+
EXERCICES
EXERCICE I
1.L’atome de sodium a pour numéro atomique Z = 11. Prévoir la formule
chimique de l’ion monoatomique issu de l’atome de sodium
2.L’atome de chlore a pour numéro atomique Z = 17. Prévoir la formule
chimique de l’ion monoatomique issu de cet atome
3.Expliquer comment se forme le sel ionique NaCl.
EXERCICE II :
Le sel de mer est majoritairement composé de chlorure de sodium NaCl. Il contient également du chlorure de
magnésium de formule MgCl2
1. Donner les structures électroniques des atomes Mg et Cl
2. En déduire les charges des ions magnésium et chlorure
3. Combien d’électrons ces ions possèdent-ils sur leurs couches externes ?
Données : Numéro atomique des éléments : Mg(Z=12) ; Na(Z=11) ; Cl(Z=17)
EXERCICE III :
1 Quelle est la valence du carbone et
de l’azote.
2 Ecrire la formule développée du
méthane et celle de l’ammoniac.
On donne les formules brutes. CH4(Méthane) ;
NH3(ammoniac.)
3. On donne la représentation de Lewis de quelques atomes
:
°Zn° I S°° I O°° °Sr° °Ba°
3.1. Quels sont
parmi ces éléments ceux qui sont :
a) Electronégatifs
b) Electropositifs ;
3.2 Donner la
formule des ions correspondants
EXERCICE IV:
1. Un atome a pour configuration électronique K2L8M7.
Combien d’électrons a-t-il sur sa couche externe ?
2. L’atome de Bore appartient à la 13ème colonne de la 2ème période. Combien
d’électrons a-t-il sur sa couche externe ?
3. Un atome a pour configuration électronique : K2L8M2
Quelle est sa position dans le tableau périodique ?
4. L’atome de phosphore appartient au groupe de l’azote qui a pour
configuration électronique : K2L5. Il est situé dans la
période suivante. Quelle est sa configuration électronique ?
EXERCICE V:
1. Choisir parmi les représentations suivantes le schéma de Lewis de
l’atome de soufre (Z=16)

2. On considère les éléments suivants appartenant à la 17ème colonne du tableau
périodique : F ; Cl ; et Br.
Construire le schéma de Lewis des molécules que chacun de ces atomes peut
former avec un atome d’hydrogène H.
CORRIGES :
EXERCICE I
1. Formule électronique du
sodium : K2L8M1 ; un seul électron
de valence (périphérique).il a tendance à perdre cet électron pour devenir
l’ion Na+.
2. Formule électronique du chlore : K2L8M7 ;
il a tendance à gagner un électron pour saturer sa derrière couche (avoir
8 électrons sur la dernière couche conformément à la règle de l’octet).
Formule chimique de l’ion monoatomique issu du
chlore : Cl-
3. Un atome est stable lorsque sa dernière
couche est saturée à 2, 8…électrons.
Ainsi, Na+ veut se débarrasser de
son unique électron externe pour avoir 8 électrons de valence. De même Cl-
a besoin d’un électron pour saturer la sienne. Lorsqu’ils se trouvent ensemble,
il y a mise en commun des deux électrons célibataires pour créer une liaison
covalente : Na-Cl
EXERCICE II :
1. Structures électroniques de Mg : K2L8M2
Structures électroniques de Cl : K2L8M7
2. Charge des ions Mg : +2
Charge des ions Cl : -1
3. Ces ions possèdent sur leurs couches externes : 2 pour Mg et 7 pour Cl
EXERCICE III :
1. Formule
électronique : K2L4 pour le carbone et K2L5
pour l’azote
Représentation de Lewis : ![]() pour le carbone et
pour le carbone et ![]() pour l’azote
pour l’azote
Valences : 4 pour le carbone et 3 pour l’azote.
2. Formule développée du méthane
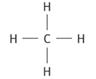
Formule développée de
l’ammoniac.
H─N─H
│
H
1) 3.1.
a) Electronégatifs : I S°° I O°°
b) Electropositifs : °Zn° °Sr° °Ba°
3.2. S2- ; O2- ;
Zn2+ ; Sr2+ ; Ba2+.
EXERCICE
IV :
1.
7 électrons
2. 3 électrons
3. Groupe 2 et Période 3
4.K2L8M5
EXERCICE
V:
1. Le soufre a 6 électrons de valence. Les 4 premiers sont dessinés non appariées,
puis on apparie les deux derniers. Le schéma de Lewis correct est donc le (b).
2. F, Cl et Br : 17e colonne =>7 électrons de valence.
![]()
Avez-vous
un exercice à proposer ?Cliquez-ici
Merci de votre visite
Laissez un commentaire