LES ALCANES
FORMULE GENERALE-NOMENCLATURE-ISOMERIE
Définitions
·
Un
hydrocarbure est un composé constitué uniquement du carbone et d’hydrogène.
·
Un
alcane est un hydrocarbure de formule générale CnH2n+2,
n étant un entier non nul. La molécule
d’un alcane ne comporte que des liaisons covalentes simples. On dit que la
molécule est saturée.
Formules développées et semi-développées
On utilise plusieurs types des formules pour
représenter les alcanes : les formules brutes, développées et
semi-développées
• Dans une formule développée, toutes les
liaisons sont représentées par des tirets. Notons que cette formule, dite
plane, ne représente pas la disposition spatiale des atomes : elle indique
simplement quels sont les atomes directement liés les uns aux autres. Pour
préciser la disposition spatiale des atomes, il faut utiliser la représentation
en perspective.
• Dans une formule semi-développée, seules les
liaisons carbone-carbone sont représentées par un tiret, simple ou double selon
la nature de la liaison. Les liaisons carbone-hydrogène ne sont pas
représentées, mais les atomes d'hydrogène sont, dans la formule, directement
accolés aux atomes auxquels ils sont liés.
Structure des alcanes
Exemple du méthane
Ø
L’étude
de la structure de la molécule de méthane (CH4) montre que
les cinq atomes ne sont pas dans un même plan. Les quatre atomes d’hydrogène
occupent les sommets d’un tétraèdre régulier dont le centre est occupé
par l’atome de carbone. La molécule de méthane est tétraédrique.
La formule développée du méthane est :
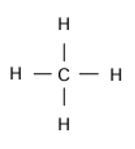
Pour représenter sur un plan une structure
tridimensionnelle, il faut utiliser des notations conventionnelles ayant une
signification spatiale telles celles de la représentation perspective.
|
|
·
Angle HCH = 109 ·
Longueurs des liaisons C-H,110pm
(1pm=10-12m). |
Par
convention, on représente :
• par un trait plein (-) ,
les liaisons situées dans le plan de figure, la valeur de l'angle entre ces
liaisons étant respectée ;
•
par un trait pointillé (----) ou par un triangle allongé hachuré (![]() ), une liaison dirigée
vers l'arrière du plan de figure ;
), une liaison dirigée
vers l'arrière du plan de figure ;
• par un triangle allongé plein (![]() ), une liaison dirigée
vers l'avant du plan de figure.
), une liaison dirigée
vers l'avant du plan de figure.
Exemple de l’éthane
Ø La molécule d’éthane
possède deux atomes de carbone, sa formule brute est C2H6.

Représentation
spatiale
Chaque atome de carbone, lié a 4 atomes, est
tétragonal. Il occupe cette fois-ci le centre d’un tétraèdre qui n’est pas
régulier. Les angles entre les liaisons sont les mêmes que dans le méthane, de
même que les longueurs des liaisons C-H.
La
molécule possède une symétrie de révolution autour de l’axe C-C, si bien que
chaque groupe CH3 peut pivoter autour de cet axe indépendamment de
l’autre : c’est le principe de la libre rotation.
|
|
·
Angle HCH = 109 ·
Liaison C-C, de longueur 154pm ·
Angle HCC =111,17 |
Nomenclature
Le nom d’un alcane se termine par le suffixe -ane.
Exemples : A partir de la
formule générale CnH2n+2
n=1 CH4
méthane
n=2 C2H6
éthane
n=3 C3H8
propane
n=4 C4H10
butane
Groupe
alkyle
Un alkyle est un alcane auquel on a retiré un
hydrogène. La formule générale du groupe alkyle est : CnH2n+1
Pour
nommer un alkyle, on prend le nom de l’alcane dont il dérive et on remplace le -ane par le -yle
Exemples :
n=1 CH3- méthyle
n=2 C2H5-
éthyle
n=3
C3H8- propyle
Nomenclature
des alcanes a chaine linéaire
Une chaîne carbonée est linéaire si elle est
constituée d'atomes de carbone liés les uns à la suite des autres, et qu'elle
ne se referme pas sur elle-même.
Exemple:
CH3-CH2-CH2-CH2-CH2-CH3
Nomenclature
des alcanes a chaine carbonée ramifiée
Une
chaîne carbonée est ramifiée si au moins un des atomes de carbone, appelé
carbone ramifié, est lié à trois ou quatre autres atomes de carbone.
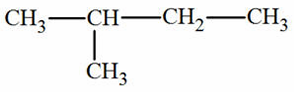
On
nomme un alcane ramifié en considérant qu'il est formé d'une chaîne principale
sur laquelle se fixent des groupes.
Etape 1 : On cherche la chaîne carbonée la
plus longue. C'est elle qui donne son nom à l'alcane.
Etape 2 : En préfixe, on ajoute le nom (sans
le e final) du groupe fixé sur la chaîne principale. On repère sa position en
numérotant la chaîne principale afin de donner le plus petit nombre au carbone
qui porte le groupe. Ce nom est placé devant le nom du groupe.
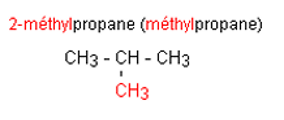
Etape
3 : Lorsqu'il y a plusieurs groupes identiques, on place le préfixe di-, tri-,
tétra- devant le nom du groupe.
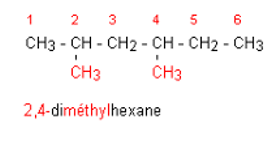
Etape 4 : Lorsqu'il y a des groupes
différents, on les nomme dans l'ordre alphabétique. Le plus petit nombre étant
affecté au groupe placé en tête dans l'ordre alphabétique.
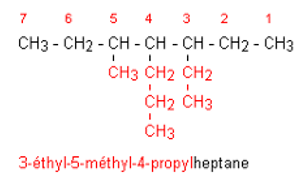
Nomenclature des alcanes à chaîne cyclique.
Une chaîne carbonée est cyclique si au moins un
des enchaînements d’atomes de carbone se referme sur lui-même.
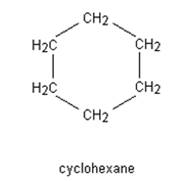
Pour
nommer un cyclane, on utilise le nom de l’alcane possédant le même nombre
d’atomes de carbone précédé du préfixe cyclo-
Pour
les cyclanes achaines ramifiée, on utilise les règles appliquées aux alcanes
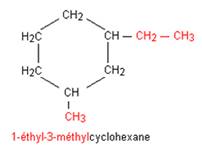
Isomérie
Les isomères sont des composés qui ont une même
formule brute, mais de formules développées différentes.
Les
alcanes présentent une isomérie de chaine : les isomères ne
diffèrent que par leur chaine carbonée.

PROPRIETES PHYSIQUES DES ALCANES
Ce sont, à pression atmosphérique, des gaz
jusqu'au C4 (butane) des liquides, jusqu'à C17 et des solides au-delà. Il faut
noter que les molécules ramifiées sont plus volatiles que les linéaires.
PROPRIETES CHIMIQUES DES ALCANES
Combustion des alcanes
Les
alcanes brûlent dans du dioxygène pour donner du CO2 et de l’eau
suivant la réaction :
CnH2n+2 +![]()
![]() nCO2 +(n+1)H2O
nCO2 +(n+1)H2O
Les
combustions sont des réactions exothermiques
Exemple du
méthane :
CH4
+2O2 → CO2+2H2O
On définit le pouvoir calorifique comme étant
la quantité de chaleur dégagée par la combustion de 1 m3 de gaz mesuré dans les
conditions normales de température et de pression. La quantité de chaleur
dégagée est de l'ordre de 37 000 kJ/m3. Combustion explosive Si l'on place
exactement un volume de méthane et deux volumes de dioxygène, la réaction est
explosive. Ceci peut se produire dans les mines où il y a des poches de
méthane, une étincelle suffit pour provoquer la réaction : c'est le coup de
grisou souvent meurtrier.
Importance
de la combustion des alcanes
Les
alcanes sont des très bons combustibles de chauffage et des carburants.
-combustibles
: méthane, propane, butane, les fuels qui sont des mélanges d’alcanes.
-carburant :
essence (ordinaire et super), gasoil, kérosènes sont des mélanges d’alcanes.
Réactions de substitution
Les réactions de substitution consistent à
remplacer dans la molécule d’alcane un hydrogène par un autre atome ou groupe
sd’atomes.il y a rupture des liaisons C-H et remplacement progressif des atomes
d’hydrogène par des atomes d’éléments halogènes : chlore, brome …
Les alcanes sont des composés saturés, ils
n’admettent que des réactions de substitution.
Halogénation
des alcanes
Chloration
du méthane

Autres
exemples d’halogénation
L’action du
brome sur les alcanes conduit à leur bromation.
Ils existent
des dérivés iodés et fluorés des alcanes, mais ils ne peuvent être obtenus
directement par réaction de substitution sur les alcanes.
Importance
des dérivés halogénés des alcanes
Les
dérivés halogénés des alcanes sont des produits de base des nombreuses
synthèses, ce sont aussi de bons solvants.
-le
chlorométhane est utilisé dans la synthèse des résines.
-le
dichlorométhane est utilisé comme diluant en peinture et aussi extraire la
caféine du café.
-le tri
chlorométhane ou chloroforme, et le tétrachlorométhane utilises autrefois comme
anesthésiques, qui sont d’excellents solvants, sont surtout utilises dans la
préparation des fréons. Les fréons sont des utilisés comme des fluides
réfrigérants dans les machines frigorigènes.
PREPARATION
DU METHANE AU LABORATOIRE
On met un peu de
carbure d’aluminium dans un grand flacon muni d’un tube à dégagement qui
aboutit dans une cuve à eau ; puis versons progressivement de l’eau acidulée
sur le carbure d’aluminium. Cela produira du méthane et l’hydroxyde
d’aluminium.
L’équation bilan de la réaction est :
Al4C3 + 12H2O→4Al(OH)3
+3CH4
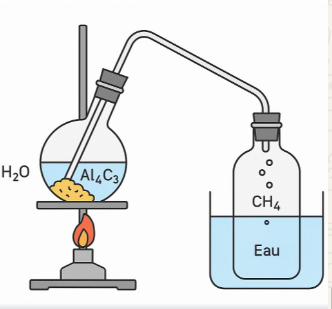
Mode
opératoire :
1. Placer une
petite quantité de carbure d’aluminium dans un ballon ou un tube à essai.
2. Ajouter
lentement de l’eau distillée.
3. Le méthane
(CH₄)
est libéré sous forme de gaz (effervescence).
4. Recueillir
le gaz par déplacement d’eau ou à l’aide d’un tube vers un récipient.
Précautions
:
- Effectuer
l’expérience sous hotte ou en milieu bien ventilé.
- Éloigner
toute flamme nue, car le méthane est inflammable.
EXERCICES
EXERCICE I : Nommer les alcanes suivants, et donner leurs formules
brutes.
1.
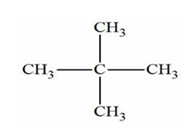
2.
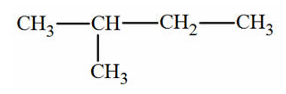
3.
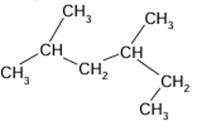
4.
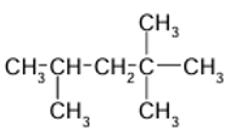
5.
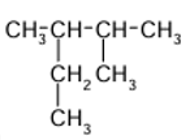
EXERCICE
II :
Ecrire les formules semi-développées des alcanes suivants :
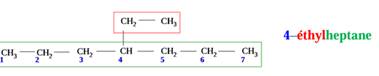
1)
4-ethylheptane
2)
3-ethyl-5-methylhexane
3)
2,3–diméthylpentane
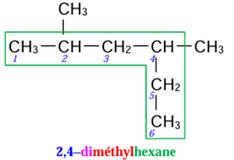
4)
2,4–diméthylhexane
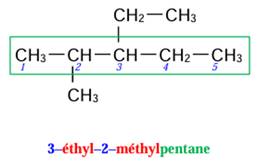
5)
3–éthyl–2–méthylpentane
EXERCICE
III :
1.on
fait bruler4,4g de propane dans un excès d’oxygène
a-Ecrire
l’équation-bilan de la réaction.
b-Calculer le volume de
CO2 obtenu dans les CNTP ?
2.
Le méthane brûle dans le dichlore en donnant du carbone et du chlorure
d’hydrogène
a-quel volume de méthane
faut-il utiliser pour obtenir 9 g de carbone ?
b-quel volume de
dichlore est nécessaire ?
3
On introduit dans un eudiomètre 40 cm3 d’un mélange d’éthane et de
propane et 200 cm3 de dioxygène. Apres passage de l’étincelle et
retour aux conditions initiales, il reste 127,5 cm3 d’un mélange
gazeux dont 105 cm3 sont absorbés par la potasse et le reste par le
phosphore.
Quelle
était la composition du mélange initial ?
NB :le phosphore absorbe le dioxygène et la potasse
absorbe le dioxyde de carbone.
EXERCICE
IV :
Le propane est commercialisé sous forme
liquide. La bouteille contient 7 kg de propane et a un volume de 10 L.
1.Quelle
est la masse volumique du propane liquide ?
2.Quelle
est la masse volumique du propane gazeux ?
3.Ce
gaz est-il plus dense que l'air ?
4.Quel
volume de gaz (CNTP) peut libérer cette bouteille ?
5.Quel
est le volume d'air nécessaire à la combustion totale du volume de propane
contenu dans la bouteille ?
6.
Quelle masse d'eau obtient-on en faisant brûler totalement 1 L de propane
gazeux ?
EXERCICE
V :
Le
méthane CH4
et le propane C3H8 sont utilisés comme
combustibles domestiques. Méthane (gaz naturel) et propane (bouteille)
Equations
:
CH4 + 2 02 => CO2
+ 2 H20
C3H8
+ 5 02 => 3 C02 + 4 H2O
1.
Sachant qu'une bouteille de propane contient 15,0 kg de gaz liquéfié, calculer
les masses d'eau et de dioxyde de carbone formées lorsqu'on brûle tout le gaz
contenu dans la bouteille.
2.Pendant
les 4 mois froids de l'année, un abonné consomme 1 500 m³ de méthane (son
volume molaire : 24,0 L/mol)
2.1-
Masse de méthane brûlé ?
2.2-
Quels volumes de dioxyde de carbone et de vapeur d'eau ont été produits ?
2.3-
Quel volume de dioxygène a été nécessaire pour assurer la combustion ?
2.4-
A quel volume d'air cela correspond-il sachant que l'air contient environ un
cinquième de dioxygène en volume ?
.
CORRIGES
EXERCICE I :
1. Le 2,2-diméthylpropane
2. Le 2-méthylbutane
3. Le 2,4-dimethylhexane
4. Le 2,2,4-trimethylpentane
5. Le 2,3-dimethylpentane
EXERCICE II :
1.
2.
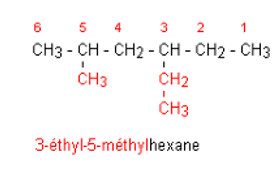
3.
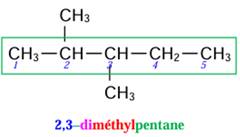
4.
5.
EXERCICE III :
1.
a-équation-bilan de la réaction.
C3H8 +2O2 → 3CO2 + 4H2O
b- volume de CO2 obtenu
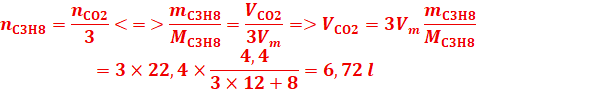
2.
a- volume de méthane
CH4 + 2Cl2→ C + 4HCl
![]()
b- volume de dichlore
![]()
3. Données :
- Volume initial du mélange C₂H₆ + C₃H₈ = 40 cm³
- Dioxygène introduit = 200 cm³
- Gaz résiduels après combustion = 127,5 cm³
- Absorbés par potasse (absorbe CO₂) : 105 cm³
- Le reste (127,5 - 105 = 22,5 cm³) est absorbé par le phosphore
(absorbe O₂ non
consommé)
Réactions de combustion :
Éthane :
C₂H₆ + (7/2) O₂ → 2 CO₂ + 3 H₂O
Propane :
C₃H₈ + 5 O₂ → 3 CO₂ + 4 H₂O
On note :
- x = volume de C₂H₆ dans le
mélange
- y = volume de C₃H₈
Avec :
x + y = 40 …(1)
Volume de CO₂ formé =
105 cm³ (absorbé par potasse)
CO₂ formé =
2x (par C₂H₆) + 3y (par C₃H₈)
Donc :
2x + 3y = 105 …(2)
Résolvons les deux équations :
(1) x + y = 40
→ y = 40 - x
Remplaçons dans (2) :
2x + 3(40 - x) = 105
2x + 120 - 3x = 105
-x + 120 = 105
x = 15
y = 25
Conclusion :
Le mélange initial était composé de :
- 15 cm³ d’éthane (C₂H₆)
- 25 cm³ de propane (C₃H₈)
EXERCICE IV :
1.Masse volumique (kg / m3) du liquide : 10 L = 0,01
m3 (1000 L= 1m3) masse (kg) / volume (m3) = 7
/0,01 = 700 kg /m3
2.masse volumique (kg / m3) du gaz : cette masse
volumique dépend de la température et de la pression dans les conditions
normales de température et de pression le volume molaire d'un gaz est 22,4 L =
0,0224 m3.
Masse molaire du propane
C3H8 : 12 . 3+8
= 44 g/mol = 0,044 kg / mol0,044 / 0,0224 = 1,96kg/m3
.3. Densité d'un gaz par rapport à l'air d = masse molaire
(g/mol) / 29 = 44/29 = 1,51 le propane est plus dense que l'air volume de gaz :
4.Quantité de matière
(mol)= masse (g) / masse molaire (g/mol) = 7000 /44 = 159 mol
Volume (L) = volume
molaire (L/mol) x Qté de matière (mol) = 22,4*159 = 3562 L.
5.combustion : C3H8 + 5O2 →
3 CO2 + 4H2O
Qté de matière de dioxygène : 5. 159 = 795 mol volume O2 : 22,4 . 795 = 17 800 L = 17,8 m3.
L’air contient en volume environ 20% de dioxygène.17,8. 5 = 89 m3
d'air.
6. A partir de 1L de propane gaz : 1 /22,4 = 0,0446 mol = 44,6
mol propane donc 4. 0,0446 = 0,178 mol d'eau 6.
Masse molaire de l'eau : 18 g/mol masse d'eau : 18 . 0,178 =3,21 g.
EXERCICE V :
Masse molaire : propane : 3x12+8=44 g/mol ;
CO2
: 12+2x16=44 g/mol;
H2O
: 2-16=18 g/mol ;
CH4 : 12+4 = 16 g/mol
1.n(C3H8)=Masse
(g) / masse molaire =15 000 / 44 = 341 mol propane donc : d'après les
coefficients de l'équation bilan
4x341 = 1364 moles d'eau ou
1364x18 = 24,5 kg eau
3x341 =
1023 moles CO2 ou 1023x44 = 45 kg
2. n(CH4)=volume (L) /
volume molaire des gaz(L/mol)= 1500 x1000 / 24 = 62500
mol méthane
2.1. Masse de méthane brulée : 62500x16 = 1000 kg.
2.2 Volume CO2 : 62500x44 = 2750 kg.
Volume Eau : :
2x62500 = 125 000 mol soit 125000x18 =2250 kg eau
2.4 Volume de dioxygène :
n(O2)=2x62500=125000
mol de O2
Volume (L) = Qté de matière (mol) * volume molaire des gaz
(L/mol) : 125000x24 = 3 000 m³
Volume d'air : 3000x5 = 15 000 m3
Avez-vous
un exercice à proposer ?Cliquez-ici
Merci de votre visite
Laissez un commentaire

