ELECTROLYSE EN
SOLUTION AQUEUSE,
CORROSION ET
PROTECTION DES METAUX
ELECTROLYSE
L’électrolyse est
l’ensemble des réactions chimiques qui s’effectuent dans une solution lors du
passage du courant électrique. Il se produit toujours :
- Une oxydation à
l’anode.
- Une réduction à la
cathode.
Les espèces qui réagissent aux électrodes pouvant participer aux réactions sont :
-les ions
et les molécules de l’électrolyte,
-le métal
de l’anode.
Théoriquement : c’est l’oxydant le
plus fort (correspondant au couple de potentiel le plus bas) qui se réduit à la
cathode, et à l’anode, c’est le réducteur le plus fort (correspondant au couple
de potentiel le plus bas) qui s’oxyde.
Une électrolyse ne peut se produire
que si l’on applique aux bornes de l’électrolyseur une tension supérieure à sa
force contrélectromotrice (fcem). Les réactions ne
s’amorcent qu’à partir d’une valeur de la tension au moins égale à la fcem de l’électrolyseur. Cette valeur est numériquement
égale à la fem de la pile réalisée à partir de cette électrolyse.
Electrolyse d’une solution aqueuse de
bromure de cuivre II
![]()
Une solution de bromure
de cuivre II Cu2+ (aq) + 2Br-
(aq)est introduite dans un tube en U. Dans chaque
branche du tube, plonge une électrode inattaquable en graphite. On réalise un
circuit électrique série à l’aide d’un générateur de tension.
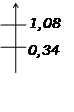
Si on fait varier la tension à partir de la
valeur V =0,8V.
On
observe :
- Un dépôt de cuivre
métallique à la cathode
- Le dégagement d’un gaz
pouvant jaunir l’hexane à l’anode : c’est du dibrome
(Br2).
Les
équations de ces réactions sont :
A la cathode : Cu2+
+ 2è → Cu
réduction
A l’anode : 2Br → Br2 + 2è oxydation
Equation bilan :
Cu2+ + 2Br- →Cu
+ Br2
Les couples mis en
jeu :
E (V)
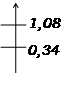
Cu2+/Cu
et Br2/Br-
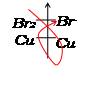
E=0,74V
Electrolyse
d’une solution d’acide sulfurique
Cette électrolyse revient à la décomposition de
l’eau en dihydrogène et en dioxygène. Les réactions aux électrodes se
traduisent par ;
2H3O+
+2e ⇀H2 +2H2O (réduction
cathodique)
3H2O
⇀![]() O2 +2H3O+ + 2e
(Oxydation cathodique)
O2 +2H3O+ + 2e
(Oxydation cathodique)
L’équation
devient :
H2O⇀H2 + ![]() O2
O2
Les
couples oxydant réducteurs mis en jeu sont :
-A
la cathode : H3O+/H2 (E°=1,23V)
-A
l’anode : O2/H2O. (E°=1,23V)
Les
phénomènes observes sont contraires aux prévisions selon la règle de gamma.
Force
contre-électromotrice et potentiel d’oxydation.
La force contre-électromotrice de
l’électrolyseur devrait être supérieure à la force contre-électromotrice d’une
pile construite à l’aide de deux couples mis en jeu, soit 1,23-0=1,23V. Or on
considère que la tension à appliquer est nettement supérieure à cette valeur,
soit e’>e. On dit qu’il y a surtension aux électrodes. Tout se passe
comme si le potentiel du couple O2/H2O avait augmenté. Ce
phénomène est lié à la lenteur des réactions aux électrodes. Il est
particulièrement fréquent lorsqu’il y a des dégagements gazeux.
Electrolyse d’une solution aqueuse de sulfate de cuivre avec anode
en cuivre
Cette électrolyse, connue sous le nom d’électrolyse à anode soluble, se traduit par le transfert du cuivre
de l’anode vers la cathode.
-Anode : Cu⇀Cu2+ +2e
-Cathode :
Cu2+ +2e⇀Cu
La
force contre-électromotrice d’un tel électrolyseur est nulle.
Conclusion :
-Les
réactions d’électrolyse sont des réactions d’oxydoréduction provoquées (elles
nécessitent de l’énergie électrique).
-la
connaissance des potentiels d’oxydoréduction est nécessaire pour prévoir les
réactions aux électrodes, mais à cause du phénomène de surtension, ces
prévisions ne sont pas toujours pas vérifiées par l’expérience.
Loi
de Faraday
La
quantité de matière formée aux électrodes d’un électrolyseur est
proportionnelle à la quantité d’électricité qui traverse l’électrolyseur et
inversement proportionnelle au faraday.
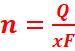
Q=It : quantité
d’électricité
x : nombre
d’électrons échangés (valence)
![]() ou
ou ![]() : nombre de moles de matière formée (mol)
: nombre de moles de matière formée (mol)
Vm : volume molaire
F : le faraday (1F=96500
C)
CORROSION ET PROTECTION DES METAUX
Corrosion du fer
Le fer et ses alliages (aciers non oxydables,
fonte), laissés a l’air humide rouillent. La rouille
est poreuse et ne protège donc pas le métal. La corrosion est la détérioration
d’un métal par oxydation en profondeur. Elle est due à la formation des micropiles. Les impuretés métalliques favorisent le
phénomène de corrosion. Elles constituent, avec le fer, des micropiles.
Si les impuretés sont constituées d’un métal moins réducteur que le fer, c’est
le fer qui est oxyde.
L’or
n’est pas altéré, l’aluminium se terni car il se recouvre d’une couche
d’alumine Al2O3 qui, imperméable, constitue une couche
protectrice.
Les méthodes de protection
-La
protection par un revêtement non métallique : il s’agit de recouvrir
l’objet à protéger d’une couche de peinture ou de matière plastique.
-la
protection par un revêtement métallique : elle peut se faire par un dépôt
électrolytique (électrolyse a anode soluble) ou en plongeant l’objet dans un
métal en fusion.
-la
protection cathodique : elle consiste à relier le fer a un métal plus
réducteur que lui qui s’oxyde à sa place.
EXERCICES
EXERCICE
I :
On réalise l’électrolyse sous électrodes en
platine d’une solution d’acide sulfurique et de sulfate de cuivre. Les
potentiels normaux des couples à considérer sont :
E(O2/H2O)=1,23V ;E(H2O/H2) =0 V;
E(Cu2+/Cu) = 0,34V
1-Ecrire
les équations bilans des réactions possibles aux électrodes. Prévoir les
réactions qui doivent s’y produire.
2-Quelle
est la valeur minimale de la tension à appliquer à l’électrolyseur ?
EXERCICE
II :
On réalise l’électrolyse du chlorure de sodium NaCl en solution aqueuse avec électrodes inattaquables.
Quelles
réactions aux électrodes peut-on prévoir à partir des valeurs de potentiels
standards suivants :
E(Na+/Na)
= -2,7V ; E(H2O/H2) = 0V;
E(O2/H2O) =1,23V ;E(Cl2/Cl-)=1,36V.
On
observe en fait un dégagement de dihydrogène a la cathode et du dichlore a
l’anode. Quelles conclusions tirez-vous de ce résultat expérimental ?
Cette
électrolyse est utilisée industriellement pour fabriquer du dichlore. Quelle
masse de chlorure de sodium (en solution) faut-il traiter pour fabriquer :
-1
m3 de chlore dans les CNTP
-une
tonne de dichlore’.
Quel
volume et quelle masse de dihydrogène obtient-on respectivement, dans ces deux
cas.
EXERCICE
III :
1-Pour
protéger la coque en fer d’un bateau, on y fixe une plaque métallique.
Parmi
les métaux suivants : zinc, plomb, magnésium, lesquels peut-on
utiliser ? pourquoi ?
2-La
masse d’une plaque de zinc, fixée à la coque d’un bateau a démunie de 20 kg au
cours d’un voyage. Expliquer cette diminution.
En
l’absence de zinc, quelle masse de fer aura été oxydée pendant le même
temps ? justifier le nom « d’anode artificielle donnée « au
plaque métalliques ixes sur les coques des bateaux.
EXERCICE
IV :
Un objet en Fer est recouvert de zinc ;
sur un autre, on a réalisé un dépôt de nickel.
Expliquer
comment fonctionnent les phénomènes de corrosion et de protection
électrochimique dans chaque cas. On donne les potentiels normaux :
E(Fe2+/Fe)=-0,44 ; E(Ni2+/Ni) = -0,23 ; E(Zn2+/Zn)=-0,76 V.
EXERCICE
V :
On utilise des anodes en magnésium pour
protéger la coque d’un navire en acier.
1.Expliquer
le mécanisme de la protection ainsi réalisé.
2.En
supposant la seule réaction réductrice qui ait lieu soit celle du dioxygène en
eau (O2/H2O).
Ou
a-t-elle lieu ?
Quelle
masse de dioxygène est réduite pendant qu’une anode de magnésium de 200g est
oxydé ?
CORRIGES
EXERCICE I :
1.Especes en solution : ![]() ; Cu2+ ; H3O+ ; H2O
; Cu2+ ; H3O+ ; H2O
Oxydations possibles à l’anode :
![]() (1)
(1)
3H2O →1/2O2
+2H3O+ +2e (2)
Réductions possibles à la cathode :
2H3O+ +2e→H2 +2H2O (3)
Cu→Cu2+ +2e (4)
Les réactions devant se produire sont : (2) et (4)
2-La fem minimum à appliquer est E(O2/H2O) -
E(Cu2+/Cu) =1,23-0,34=0,89 V.
EXERCICE II :
1-Réductions possibles à la cathode
2H2O + 2e → H2+2HO- (a)
Na+ + e → Na (b)
Oxydations possibles à l’anode :
3H2O → 1/2O2 +2H3O+
+2e (c)
2Cl- → Cl2
+2e (d)
Au vu des potentiels de ces couples ce sont les réactions (a) et (c)
qui devraient se produire.
2-Ce résultat expérimental n’est pas en accord avec les prévisions.
En effet, c’est la réaction(d) au lieu de la (c) qui se produit.
3-Equation globale de la réaction :
2H2O + 2(Na+ + Cl-)
→ H2+Cl2 +2(Na + HO-)
2mol 1mol
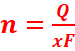
![]()
EXERCICE III :
1-Pour protéger la coque d’un bateau en fer, on doit utiliser un des
métaux plus réducteurs que le fer, soit le zinc, soit le magnésium.
2-Cette diminution s’explique par le fait que le zinc étant plus
réducteur que le fer, va s’oxyder en présence des agents corrosifs :
Zn→Zn2+ +2e
Calcul de la masse de er qui aurait été oxydée en l’absence du
Zinc :
Fe→Fe2+ +2e
Il y a conservation de la quantité d’électricité, on constate que
pour l’oxydation d’une mole de zinc ou une mole de fer, il y a libération de
deux moles d’électrons, soit :
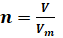
EXERCICE IV :
Dans les deux cas si la couche protectrice du Zn ou de Ni est sans
fissures, la protection du fer est assurée, En revanche s’il y a fissure sur la
couche, on assistera à :
-Comme E(Fe2+/Fe) > E(Zn2+/Zn) donc le
réducteur le plus fort est le zinc, le zinc va s’oxyder et il y aura toujours
protection du fer.
-Comme E(Ni2+/Ni)> E(Fe2+/Fe) donc le fer
est plus réducteur plus fort que le nickel, il y aura une accélération de
l’oxydation du fer.
EXERCICE V :
1.Il s’agit d’une protection électrochimique ou le métal plus
réducteur Mg a s’oxyder :
Mg → Mg2+ +2e
2.Equation bilan de la réaction :
O2 +4H3O+ +4e→6H2O
Mg→Mg2+ +
2e
Bilan :
O2 +4H3O+ + Mg → 6H2O
+ 2Mg2+
1mol
2mol
Calcul de la masse de dioxygène :
![]()
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez un commentaire