QUELQUES DOSAGES
D’OXYDO-REDUCTION
Doser
une solution, c’est déterminer sa concentration. Toutes les réactions d’oxydo-réduction
peuvent être utilisées pour des dosages. Il faut en effet que la réaction soit
rapide et totale. Il faut aussi pouvoir repérer rapidement le point
d’équivalence. L’équivalence est atteinte lorsque les quantités d’oxydant et de
réducteur en présence sont dans les proportions stœchiométriques.
 Dosage d’une
solution d’ions Fe2+ par une solution MnO-4
Dosage d’une
solution d’ions Fe2+ par une solution MnO-4
Expérience :

![]()

On
introduit dans une burette une solution oxydante de permanganate de potassium
concentration C0 connue, et dans le bécher une solution
réductrice contenant les ions Fe2+, de volume Vr
connu et de concentration Cr à déterminer. Il faut suffisamment acidifier le
milieu, faute de quoi l’ion permanganate serait réduit à l’état de dioxyde de
manganèse MnO2, solide brun, et non à l’état d’ion Mn2+.
On verse progressivement cette solution dans la
solution de l’ion Fe2+.
Observation :
Le permanganate se décolore au contact des ions
Fe2+. Dès que les ions Fe2+ sont tous oxydés, le
permanganate ne se décolore plus, la couleur violette persistante permet de
repérer le point d’équivalence.
Le volume Vo de la solution oxydante utilisée
pour la réaction est repéré par la descente de la burette.
L’équation bilan de la réaction s’écrit :
|
MnO-4 + 5Fe2+ + 8H3O+
→ Mn2+ + 5Fe3+
+ 12H2O |
Au point équivalent :![]()
![]()
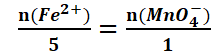
![]()
![]()
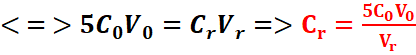
L’ion permanganate en milieu acide est très
utilisé pour effectuer les dosages d’oxydoréductions : C’est la manganimétrie.
L’IC (Indicateur Coloré) est l’ion permanganate lui-même.
NB : La persistance de la
couleur violette doit être obtenue à une goutte près.
 Dosage d’une solution de diiode par une solution
d’ions thiosulfate
Dosage d’une solution de diiode par une solution
d’ions thiosulfate
Expérience : On place un volume V0 d’une solution de diiode
dans un bécher. On y verse progressivement une solution de thiosulfate de
sodium de concentration Cr contenue dans une burette.
2Na+ + S2O2-3
![]()
![]()

Observation :
La
couleur brune du diiode disparait peu à peu. L’équivalence est obtenue (le
diiode a été entièrement réduit) lorsque la solution devient incolore. Mais
comme ce changement de teinte est imperceptible, on utilise un IC (Indicateur
Coloré) : quelques gouttes d’empois d’amidon donnent à la solution du
diiode la teinte bleue.
Soit à déterminer le
concentration C0 d’une solution de diiode de volume V0
qui vire du brun à l’incolore. La descente de la burette de la solution Vr de (2Na+ + S2O2-3,)
de concentration connue Cr.
L’équation de la réaction s’écrit :
|
2S2O2-3
+ I2 →S4O2-6
+ 2I- |
|
2mol 1mol |
A
l’équivalence : 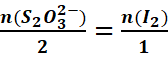
<=>![]()
=>
Le
diiode est très utilisé dans le dosage d’oxydoréduction : C’est l’iodométrie.
EXERCICES
EXERCICE I :
1-Ecrire
les demi-équations des réactions d’oxydation des ions Fe2+ et de
réduction des ions MnO-4 en milieu acide.
En déduire l’équation bilan de la réaction
entre les ions Fe2+ et MnO-4.
2-Quel
volume d’une solution de KMnO4 a 10-2 mol/l faut-il
ajouter à 200 ml d’une solution de sulfate de Fer II (FeSO4) a 10-3
mol/l pour que la teinte violette persiste ?
EXERCICE II:
On
dissout une masse m de sulfate de Fer II ( Fe2SO4 ) anhydre (M=152 g.mol)
dans une solution d’acide sulfurique et on complète le volume a 50 ml. Cette
solution est titrée au moyen d’une solution de permanganate de potassium de
concentration 0,2 mol/l. l’équivalence est obtenue après addition de 19,3 ml de
solution de permanganate de potassium.
1-Ecrire l’équation bilan du dosage.
2-Calculer la concentration de la solution
réductrice en ions Fe2+ et la masse m de sulfate de fer II qui a été
dissoute dans l’acide sulfurique.
EXERCICE III:
1-On
veut doser une solution de diiode dans l’iodure de potassium par une solution
de thiosulfate de sodium Na2S2O2.
Décrire
la méthode employée. Quelle précaution faut-il prendre pour repérer
l’équivalence de façon précise ?
2-Il
faut verser 11,2 ml de solution de thiosulfate de sodium de concentration 0,1
mol/l dans 10 ml de solution de diiode pour obtenir l’équivalence.
Déterminer
la concentration cherchée.
EXERCICE IV: Au cours d’une
séance de TP, le professeur demande à un élève de préparer une solution d’ions
Fe2+ de concentration 0,1 mol/l à partir des cristaux de sulfate de
fer II hydratés : FeSO4 ,2H2O.
1-Comment
l’élève doit-il procéder pour obtenir 500 cm3 de solution ?
2-Pour
contrôler le travail effectué, le professeur demande à un autre élève de
déterminer la concentration de la solution obtenue par dosage à l’aide d’une
solution de permanganate de potassium de concentration 0,04mol/l. Indiquer le
mode opératoire à suivre.
Sachant
que 10,1 cm3 de solution de permanganate de potassium ont été
nécessaire pour doser 20 cm3 de la solution d’ions Fe2+,
peut-on en déduire que la solution a été bien préparée ?
EXERCICE
V:
Papa
François a fait une chute de vélo et s’est blessé au genou. Pour désinfecter sa
plaie, il se propose d’utiliser une vieille solution de Bétadine trouvée dans
sa boite à pharmacie et dont l’étiquette du flacon porte les inscriptions
suivantes :
Substance active : I2 ;
Pourcentage massique en diiode : P(I2)=10%
Densité d=1,03
Son fils inquiet souhaite au préalable vérifier si cette solution de Bétadine
est encore utilisable. Pour cela, il réalise les expériences suivantes :
• il dilue 10 fois la solution initiale de Bétadine notée S0 de
concentration en diiode Co(I2) et obtient une
solution S1 telle que Co(I2)= 10C1(I2);
• Il dose un volume V1 =10 mL de la
solution diluée par une solution aqueuse de thiosulfate de sodium de
concentration C2 = 0,1 mol/L en présence d'empois d’amidon. Le point
équivalent est obtenu lorsque le volume de la solution de thiosulfate versé est
V2 = 8,1 mL
Informations:
Equation-bilan support du dosage : 2S2O2−3+I2 →S4O2−6+2I−
Formule de calcul du pourcentage en diode de la solution So :
P(I2)= C0(I2)×MI2d×ρeau 100
P(I2) pourcentage en masse de diiode de la solution So
de bétadine.
C0(I2) concentration en diiode I2 en moL/L de la solution So
MI2 masse molaire du diiode en g/mol
d densité de la solution So de bétadine.
ρeau masse volumique de l'eau en
g/L.
Solution utilisable si P(I2) est compris dans l'intervalle
[8% - 10%]
Masse molaire de l'iode: MI = 127 g/mol
ρeau=1000 g/L
En utilisant les informations ci-dessus et à l’aide d’une démarche
scientifique,
1- Propose un mode opératoire assorti d’un dispositif expérimental adéquat du
dosage effectué.
2- Examine si la solution de Bétadine trouvée dans la boite à pharmacie est
encore utilisable. (probatoire C, D et E 2022)
EXERCICE
VI:
Mme
MAGOU a trouvé dans sa cave un vin incolore offert par un ami il y’a trois ans.
Doutant de sa qualité, une analyse dans un laboratoire lui a été conseillée
afin de vérifier la concentration en dioxyde de soufre présent dans ce vin.
La concentration maximale en dioxyde de soufre autorisée dans un vin par la
législation est de 6,5 mmol/L.
Les travaux effectués et les résultats obtenus sont consignés dans le tableau
suivant :
• Dosage de
20 mL du vin acidifiée contenant du dioxyde de
soufre SO2 par
une solution aqueuse de permanganate de potassium de concentration C=10−3 mol/L
• Volume de permanganate obtenu à l'équivalence : 17,2 mL.
Support :
Equation-bilan de la réaction de dosage :
2MnO−4+5SO2+ 6H2O→2Mn2++ 5SO2−4+4H3O+
l - Décrire en l’aidant d'un schéma le mode opératoire de ce dosage.
2- En effectuant tous les calculs nécessaires, examine si ce vin est encore
conforme à la législation. (Probatoire C, D, E et TI 2023)
CORRIGES
EXERCICE I :
1- Demi-équations des réactions d’oxydation des ions Fe2+
et de réduction des ions MnO-4 en milieu acide.
Fe2+ "Fe3+
+ è
MnO-4 + 8H3O+ + 5è → Mn2+ + 12H2O
Équation bilan de la réaction entre les ions Fe2+ et MnO-4.
MnO-4 + 8H3O+
+ 5Fe2+ → Mn2+ + 12H2O + 5Fe3+
2-Volume d’une solution de KMnO4
![]()
1-Equation bilan du dosage.
MnO-4 + 8H3O+
+ 5Fe2+ → Mn2+ + 12H2O + 5Fe3+
2- Concentration de la solution réductrice
en ions Fe2+
![]()
Masse
m de sulfate de fer II .
m=Mxn(Fe2SO4)=MCrVr=x152x0,386x005=2,93 g
EXERCICE III:
1- Pour repérer l’équivalence de façon précise, il faut ajouter d‘empois
d’amidon.
2- A l’équivalence,
CoVO = 2CrVr
=> C0 = CrV0/2V0=0,1x10/2x11,2=0,045 mol/l
EXERCICE IV
:
1-
M=57+32+4x16+30=172 g/mol
n=m/M et c=n/V=m/MV =>m=cVM=0,1x500.10-3x182=9,1 g
-Il doit peser 9,1 g de FeSO4 ,2H2O et l’introduire
dans une fiole jaugée de 500 ml
- ajouter environ 50 ml d’eau distillée dans la fiole et agiter.
-compléter ensuite avec l’eau distillée jusqu’au trait de jauge et
agiter une dernière fois.
2-
![]()
La solution a été bien préparée.
EXERCICE V :
1- Il
est question ici de proposer un mode opératoire du dosage effectué.
Schéma du dispositif expérimental :

Protocole
de dosage :
• Remplir la burette avec la solution de thiosulfate de sodium ;
• Introduire 10 mL de la solution diluée de Bétadine dans
L’erlenmeyer ou le bécher et y ajouter quelques gouttes d’empois d’amidon ;
• Faire couler progressivement la solution de thiosulfate de sodium contenue
dans la burette ;
• L’équivalence est obtenue par la décoloration du mélange contenu dans le
bécher ou l’erlenmeyer.
Autre
Protocole à valider :
Verser progressivement la solution diluée de thiosulfate de sodium de la
burette dans le bécher ou l’erlenmeyer contenant l0 mL
de solution diluée de Bétadine.
A l’équivalence on observera une décoloration de la solution du ‘bécher ou de
l’erlenmeyer. (Passage du jaune-brun à l’incolore ou du bleu à l’incolore si on
a utilisé de l’empois d’amidon).
2- Il
est question de vérifier si la solution de Bétadine est encore utilisable.
Pour cela :
• Calculer la valeur de C1(I2)
• Déduire celle de C0(I2)
• Calculer la valeur P(I2)
• Vérifier si P(I2) est compris dans l’interva1le [8%−10%]
• Conclure.
• Equation-bilan support du dosage
2S2O2−3+I2→ S4O2−6+2I−
Déterminons la concentration de la solution diluée C1
A L’équivalence on a :
n(S2O2−3)/2=n(I2)/1 ;
C2V2/2=C1V1 ⇒C1=C2V2/2V1
C1=0,0405 mol/ L
• Déterminons la concentration C0(I2)
C0(I2)= 10C1(I2)=0,405 mol/L
• Déterminons P(I2)
P(I2)= 0,405×2×127×1001,03×1000 =9,997%
P(I2)=9,997% ≈10%
Conclusion : P(I2) étant compris dans
l’intervalle [8%−10%]. La solution de Bétadine trouvée dans
la boite à pharmacie est encore utilisable
EXERCICE VI:
Tâche
1 :
• Problème scientifique : description du protocole du dosage de SO2 du
vin par les ions permanganate.
• Actions à mener :
1. Dessiner le dispositif expérimental du dosage ;
2. Décrire le mode opératoire du dosage.
• Résolution :

On
réalise le montage ci-dessus ;
• Prélever à l’aide d’une pipette 20 mL de vin
acidifié (solution de dioxyde de soufre) qu'on verse dans un erlenmeyer ou un
bécher ;
• Remplir la burette graduée avec la solution de permanganate ;
• Laisser couler la solution de la burette mL par mL, puis goutte par goutte en prenant soin d’agiter le
mélange jusqu’à la persistance de la teinte violette dans l’erlenmeyer (point
d’équivalence).
• Relever la descente de burette qui correspond au volume à l’équivalence
(faire la moyenne après plusieurs essais).
Tâche
2 :
• Problème scientifique : détermination de la concentration en SO2 du
vin-
• Actions à mener :
1. Exploiter l'équation-bilan support du dosage pour établir la relation entre
les quantités de matières de SO2 et de MnO−4.
2. Exprimer et calculer la concentration en S02 du vin.
3. Comparer à la norme et conclure.
• Résolution :
D’après l’équation-bilan support du dosage on a, à l’équivalence :
2MnO−4
+5SO2+ 6H2O → 2Mn2++ 5SO2−4+4H3O+
n(Mn
O−4) =n(SO2)5⇒ n(SO2)=5/2n(MnO−4)
[SO2]=5/2[MnO−4]Ve/Vvin=2,5x10-3x17,2/20
AN : [SO2]=2,15×10−3 =
2,15mmol/L
• Comparaison et conclusion : 2,15 mmol/L < 6,
5mmol/L, alors le vin est encore conforme à la législation
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez un commentaire