PILES ET ACCUMULATEURS
PILES
Description et principe de fonctionnement d’une pile.
La pile est un ensemble constitué d’électrolyte
en contact avec deux électrodes de nature différentes. Lorsque la pile
fonctionne, elle est le siège d’un ensemble de réaction chimique qui libère de
l’énergie.
La
pile transforme cette énergie chimique en énergie électrique : On dit
qu’elle est un générateur électrochimique de courant continu.
Etude de quelques piles :
Exemple de la
pile Volta.
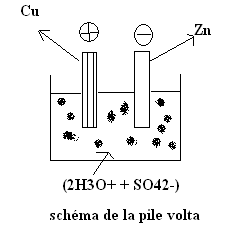
La pile est
constituée de deux électrodes : une en zinc, l’autre en cuivre,
plongeant toutes dans une solution d’acide sulfurique. Les
équations des réactions aux électrodes sont :
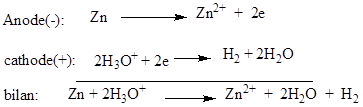
La
f.é.m. de la pile volta est E≈1V.
NB :
Le
courant électrique est dû au mouvement d’ensemble des électrons de l’électrode
de zinc vers celle de cuivre.
On
l’appelle pile polarisable car une partie de dihydrogène produit au pôle
positif de la pile forme une gaine autour de l’électrode de cuivre, ce qui
augmente la résistance de la pile entrainant une diminution de l’intensité du
courant.
Pile à dépolarisant : Exemple de la pile Leclanché.
Description
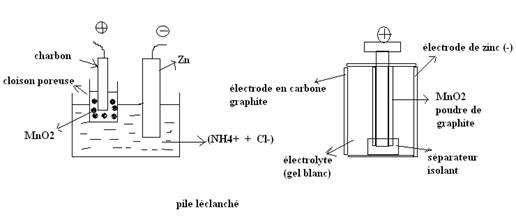
NB : le MnO2 est le
dépolarisant (il empêche la pile de se dépolariser).
La
pile Leclanché est une pile saline, elle est aussi dite pile sèche car
l’électrolyte ne coule pas.
Fonctionnement
Lorsque
la pile débite, les équations aux électrodes sont :
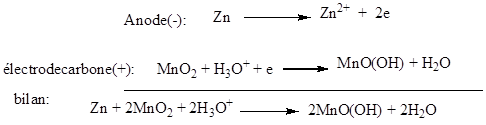
Le
dépolarisant favorise un courant de longue durée, la pile cesse de fonctionner
dès qu’il y a manque de zinc ou de MnO2.
Une pile impolarisable : Exemple
de la pile Daniell.
Description
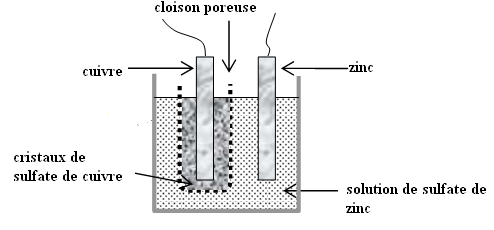
Fonctionnement
Les
réactions aux électrodes sont :
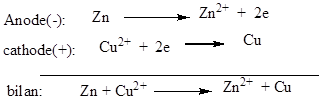
La
f.é.m. est E ≈1,08V.
La
solution s’appauvrie en Cu2+. Pour maintenir la saturation de la
solution en solution en Cu2+, on dépose au fond du vase poreux des
cristaux de sulfate de cuivre.
La pile alcaline.
Description
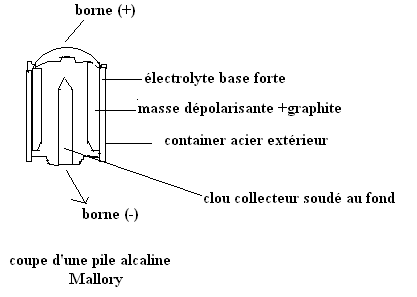
Fonctionnement
Cette
pile fonctionne de la même façon que la pile Leclanché. Son électrode négative
étant constituée de zinc et celle positive, de MnO2. Sa f.é.m. est
de 1,5V.
Les
piles alcalines ont un pouvoir énergétique plus élevé et une grande capacité.
LES
ACCUMULATEURS.
Définition.
Un accumulateur est un dispositif
capable de stoker de l’énergie électrique sous forme chimique et de la
restituer, que l’appareil soit connecté ou non au secteur.
Une
batterie d’accumulateur est un générateur électrochimique déchargeable.
Fonctionnement
Un
accumulateur fonctionne en charge ou en décharge. Pour charger un accumulateur,
on le branche aux bornes d’un dipôle actif.
Pendant
la charge ou polarisation, l’accumulateur fonctionne en récepteur. Il
transforme l’énergie électrique reçue en énergie chimique.
Pendant
la décharge, ou dépolarisation, l’accumulateur fonctionne en générateur, il
transforme l’énergie chimique en énergie électrique.
Les
caractéristiques électriques d’un accumulateur :
-
la
force électromotrice : Elle est indiquée en volt sur
l’accumulateur.
-
La
capacité : c’est la quantité d’électricité que l’accumulateur
peut fournir au cours de la décharge. Elle s’exprime généralement en ampère-heure
(Ah) et 1Ah = 3600C.
Le rendement en quantité d’électricité.
La quantité d’électricité consommée au
cours de la charge pendant le temps tC
sous un courant IC est :
QC=ICtC
La quantité d’électricité fournie à la
décharge pendant le temps tD sous un
courant ID est :
QD=IDtD
Le rendement en quantité est le rapport
de la quantité d’électricité QD au cours de la décharge par la
quantité d’électricité QC qui traverse l’accumulateur au cours de la
charge :
![]()
Le rendement en énergie.
Comme la résistance est très faible,
l’effet joule est négligeable et l’énergie consommée a la charge se réduit
pratiquement à celle transformée en énergie chimique :
WC=ECQC
Quant à l’énergie électrique fournie pendant la
décharge :
WD=EDQD
Le rendement
de l‘énergie électrique WD fournie au cours de la décharge à
l’énergie électrique WC consommée au cours de la charge.
![]()
NB :
On
appelle cyclabilité, le nombre de cycle
« charges-décharges » qu’un accumulateur peut effectuer.
Quelques types d’accumulateurs.
L’accumulateur au plomb.
Ø A la décharge, il
se produit les réactions :
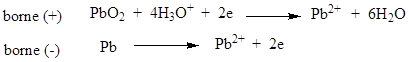
La
f.é.m. de chaque élément est de 2V.
Remarque :
Lorsque
la décharge de l’accumulateur est importante, l’augmentation de la
concentration en ions pb2+peut conduire à la formation d’un
précipité de sulfate de plomb tel que :
![]()
Ø A la charge :
Les réactions s’inversent au niveau des électrodes.
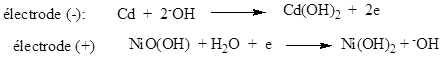
La
f.c.é.m. des éléments est E’ = 2,2V
Accumulateur cadmium-nickel.
Ø A la décharge, on
a :
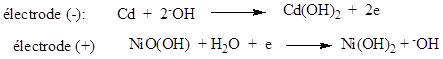
La
f.é.m. d’un élément d’accumulateur cadmium-nickel est de 1,3V.
Pendant
la charge, les réactions ci-dessus s’inversent.
EXERCICES
EXERCICE
I :
Un
voltmètre très résistant branché entre les bornes d’une batterie de 10 éléments
d’accumulateurs identiques associés en série, indique 20 V en circuit ouvert et
19,8 V quand la batterie débite dans un résistor de résistance 9,9 Ω.
1. Calculer la
fem et la résistance interne de chaque élément.
2. Quelle
serait l’intensité du courant si l’on court-circuitait les deux bornes de la
batterie par un résistor de résistance négligeable ?
EXERCICE
II :
Un
accumulateur présente, en charge une fcem moyenne de
2,2 V ; sa charge demande un courant de 2 A pendant 20 heures ;
sachant que ce accumulateur débite dans un courant de décharge les 8/10 de la
quantité d’électricité qui l’a traversé pendant la charge et que la valeur
moyenne de sa fem pendant la décharge est 1,9 V. Calculer :
1.Sa capacite.
2.L’energie
électrique transformée en énergie chimique pendant la charge.
3.L’energie
chimique rendue pendant la décharge.
4.L’intensite
du courant de décharge (suppose constant) quand celui-ci s’effectue en 10
heures.
5.Le rendement
en énergie.
EXERCICE
III :
1.Un générateur
de fem égale a 46 V et de résistance 1,5Ω sert a charger une batterie de 20 éléments d’accumulateurs, mis
en série, ayant chacun une fcem constante égale a 2 V et une résistance interne de 0,05 Ω. On néglige
la résistance des fils de jonction.
Calculer
l’intensité du courant dans le circuit.
2.Conservant le
montage du 1, on dispose entre les bornes de la batterie un résistor variable
R. pour une certaine valeur R1 du résistor, la ddp
aux bornes de la batterie est 45,5 V. quelles sont les intensités des courants
qui parcourent : le générateurs, la batterie, la résistance ?
Préciser la
valeur R1 du résistor R.
EXERCICE
IV :
Une
batterie d’accumulateur au plomb est chargée de 40 Ah.
1. La
batterie se décharge complètement en 1 h. La tension au cours de cette décharge
est 11,8 V. Quelle est l’énergie électrique fournie ?
2. On utilise la batterie pour démarrer une
automobile pendant 1,5 s. La batterie est alors traversée par un courant
d’intensité 0,2 kA et la tension à ses bornes est de 10,2V.
(a)
Quelle est l’énergie électrique fournie ?
(b) Quelle est la puissance électrique ?
EXERCICE
IV :
Un
accumulateur au plomb (batterie de voiture) peut être schématisé par une
électrode de plomb et une électrode inerte recouverte de dioxyde de plomb
plongées dans une même solution contenant de l’acide sulfurique et du sulfate
de plomb.
1. Ecrire
les deux demi-équations redox ainsi que la réaction naturelle de la pile. E0Pb2+/Pb =
- 0.13V et E0PbO2/Pb2+ = 1.45V.
2. Quelle
est la force électromotrice de cette pile en conditions standards ?
3. Sachant
qu’on est en solution aqueuse et en milieu acide, montrer que PbO2 et
Pb sont consommés par des réactions parasites même lorsque l’accumulateur est
en circuit ouvert. E0O2/H2O = 1.23V et E0H+/H2 =
0.00V.
4. Cette
batterie a une capacité de 133 Ah et elle est employée sous une
intensité de 90A pour le démarrage de la voiture. Quelle masse minimum de
dioxyde de plomb doit-elle contenir ?
MPb = 207 g.mol-1 et MO = 16g.mol-1.
CORRIGES
EXERCICE
I :
1. En
circuit ouvert, I=0, U=E=20 <=
>nE1=20=>E1=20/10=2 V.
Quand
la batterie débite dans un résistor, U=E1-(R+r)I
2. Si
on court-circuite les deux bornes de la batterie, U=0
U=E1-rIcc=0 =>Icc=E/r=20/0,1=200
A
EXERCICE
II :
1.
Quantité
d’électricité au cours de la charge : QC=It=2X20=40 Ah
Quantité
d’électricité au cours de la décharge : QD=8/10x40=32 Ah
La
capacite est QD= 32 Ah
2. WC=ECQC=2,2x40=88
Wh
3. WD=EDQD=1,9x32=60,8
Wh
4.ID=32/10=3,2 A
.5.rW=60,8/88=0,69.
EXERCICE
III :
1.
![]()
2.
Générateur :
U=E-rI =>I=(E-U)/r=(46-41,5)/1,5=3 A
Batterie: U=E’ +r.I2 =>I2=(-E’+U)/r’=(-40+41,5)/1=1,5
A
Resistor: I1=I-I2=3-1,5=1,5
A
R1=U/I1=41,5/1,5=27,67Ω
EXERCICE
IV :
1.
QD=IDt =>ID= QD/t=40/1=40
A
W=UIDt=11,8x40x1=472Wh
2. On utilise la batterie pour démarrer une automobile pendant 1,5
s. La batterie est alors traversée par un courant d’intensité 0,2 kA et la
tension à ses bornes est de 10,2V.
(a) W=UIt=10,2x0,2103x1,5=3,06 KJ ou 0,85 Wh
(b) P=UI=10,2x0,2.103=2,04 KW
EXERCICE
V :
1. On
a au pôle négatif (production d’électrons) Pb = Pb2+ + 2é.
Au
pôle positif (consommation d’électrons) PbO2 + 4 H+ +
2é = Pb2+ + 2 H2O
2. En
conditions standards on a E = E+ - E- = E0PbO2/Pb2+ -
E0Pb2+/Pb = 1.58V
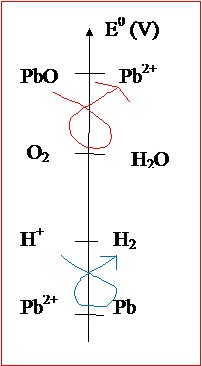
3. On
peut représenter les couples sur une échelle :
On
remarque que l’électrode recouverte de PbO2 peut réagir avec
l’eau (gamma rouge), et que celle en plomb peut réagir avec les ions H+ de
l’acide sulfurique (gamma bleu).
3.
On a Q = 133 Ah = 133x3600 = 4.79 105 C
![]()
![]()
Donc
mPbO2 = n0.MPbO2 = 595 g
Avez-vous
un exercice a proposer?Cliquez-ici
Merci de votre visite
Laissez un commentaire