CARACTERISTIQUES DE LA
MATIERE
Les états de la matière
La matière se présente sous trois états :
l’état solide, l’état liquide et l’état gazeux.
Etat
solide
-
Les solides possèdent une forme et un volume propres.
-
Les solides sont incompressibles :
-
Certains solides sont élastiques :
Etat
liquide
-Les liquides prennent la forme du vase
qui les contient.
-
Les
liquides sont incompressibles :
-
Les
liquides sont inextensibles :
Etat gazeux
-
Les
gaz sont expansibles : ils occupent tout l’espace qui lui est offerts.
-
Les
gaz sont compressibles : on peut réduire le volume de l’air dans un ballon
gonflé.
-
Les
gaz sont élastiques : quand on lâche la poignée d’une pompe compressée,
l’air repousse le piston et le ramène a
son point de départ.
Remarque
: les
liquides et les gaz sont des fluides parce qu’ils peuvent « couler ».
Les
changements d’états
Un même corps peut se présenter sous les trois
formes. Par exemple, l’eau liquide se transforme par solidification en glace et
par vaporisation en un gaz : la vapeur d’eau. Cette vapeur d’eau, par
condensation ou liquéfaction, redevient de l’eau liquide. La glace (eau solide)
se transforme par fusion en eau liquide.
Les changements d’état dépendent de la
température et de la pression
Température
de changement d’état
On appelle température de changement d’état d’un
corps, la température à laquelle ce corps passe d’un état physique a un autre.
-température
de fusion
-température
d’ébullition ou de vaporisation
-température
de solidification.
Transformation
physique
Une transformation physique est un phénomène au
cours duquel il n’y a ni création, ni
disparition de la matière.
Exemple :
-
La
fusion de la glace en eau
-
La
dilution du sucre dans l’eau.
Corps purs et mélanges
Corps purs
Un corps pur est un corps dont on ne peut pas séparer les différents constituants
Exemple :
eau
distillée, cyclohexane

Obtention de l’eau distillée
Mélanges
Un mélange est composé de plusieurs substances
mélangées physiquement sans réaction chimique.
Il
existe les mélanges homogènes et les mélanges hétérogènes :
-
Un mélange homogène a un aspect uniforme, on ne distingue pas les constituants
à l’œil nu.
Exemple : eau salée
-
Un mélange hétérogène laisse apparaître plusieurs phases ou éléments visibles.
Exemple :
eau
des rivières.
Remarques :
-Une
eau pure (eau distillée) est différente d’une eau potable. En effet, l’eau que
nous buvons contient des sels minéraux et des gaz dissous qui lui donne sa
saveur et la rend plus digeste : c’est un mélange.
-L’air
« pur » que nous allons respirer en campagne est en fait un mélange
d’oxygène, d’azote et des gaz rares.
-l’eau
salée est un mélange.
Critères de pureté d’un corps
Le critère de pureté d’un corps est une
grandeur physique caractéristique de ce corps et qui ne change pas.
Parmi
les critères de pureté, on trouve :
-température de changement d’état :
température d’ébullition, température de solidification, température fusion,
-constantes physiques : masse volumique,
densité, solubilité, chaleur massique etc.
Pour
un corps pur,
-
la température reste constante au cours d’un changement d’état, ce qui se
traduit graphiquement par un palier de température.
-A
une pression donnée, la température de fusion est égale à la température de
solidification, la température d’ébullition est égale a la température de liquéfaction,
Exemples :
1-Cas
de la solidification de l’eau pure
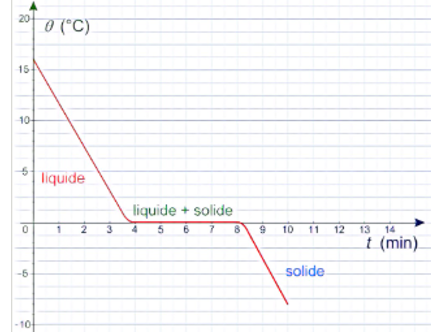
Courbe de
solidification de l’eau pure
-A t=0, l’eau est
liquide la température est a plus de 15 degrés.
-A t=4 min, l’eau
commence à se solidifier, la température est 0 degré.
-Entre 4 et 8 mn, la
température reste fixe à 0 degré. On observe un palier de température.
-A t>8 mn, l’eau
devient solide(glace)
Le palier montre que la
température reste constante, c.-à-d. qu’aussi longtemps que l’intégralité du
corps n’a pas changé d’état, la température reste fixe. Pour un corps pur, un
changement d’état se fait lors d’un palier de température.
3-Cas
de la solidification de l’eau salée

Courbe de solidification de l'eau salée
Ces informations permettent de mieux comprendre le comportement de l'eau salée lors de sa solidification.
4-Cas
de la solidification du cyclohexane
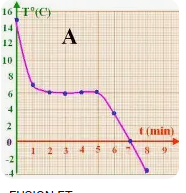
Courbe de solidification du cyclohexane
Il
s'agit du changement d'état d'un corps pur, car la courbe montre une transition
claire entre les états sans plateaux irréguliers, ce qui indique une pureté. Le
cyclohexane commence à se solidifier à 6°C, où la température
commence à descendre et où l'état passe de liquide à solide.
Conductibilité électrique et dureté des matériaux
Conductibilité
La conductibilité électrique est la propriété
des matériaux de transmettre l’électricité.
On
appelle :
-conducteurs, les matériaux qui ont une
conductibilité élevée.
Exemples : le fer, le cuivre et presque tous les
métaux.
-isolants, les matériaux qui ont une
conductibilité faible.
Exemples : le bois sec, plastique.
Dureté
La dureté d’un matériau est sa capacite
à résister à la pénétration d’un objet extérieur.
Alliages
Les alliages s’obtiennent en mélangeant, à
l’état liquide, un métal pur avec un ou plusieurs autres métaux, ou avec des
corps purs non métalliques.
Exemples :
-acier :
composé du fer et moins de 2% de carbone,
-fonte :
composé du fer et entre 2,1 et 6,67% de carbone,
-bronze :
composé de cuivre et de 5 à 25% d’étain.
La formation des alliages répond à deux
préoccupations :
-améliorer les propriétés mécaniques des
métaux,
-lutter contre la corrosion
Les
alliages sont des bons conducteurs d’électricité.
La
dureté des alliages est plus grande que celle des métaux purs (fer, cuivre,
zinc, et aluminium).
EXERCICES
EXERCICE
I :
On
vous donne plusieurs liquides dans des béchers. Parmi eux, lesquels sont des
corps purs et lesquels sont des mélanges ?
-
A : Eau distillée
-
B : Eau sucrée (eau + sucre)
-
C : Alcool à 90%
-
D : Huile d’olive
-
E : Jus de fruits industriel
Questions
:
1.
Classez chaque liquide en corps pur ou mélange.
2.
Expliquez brièvement pourquoi.
On dispose des
échantillons suivants :
1. Eau de mer
2. Glucose pur
3. Air (dans une
bouteille)
4. Lait entier
5. Eau déminéralisée
Questions :
a) Pour chaque
échantillon, dites s’il s’agit d’un corps pur ou d’un mélange.
b) Expliquez pourquoi.
EXERCICE
III –
Mélanges homogènes ou hétérogènes ?
Observe
les situations suivantes et indique pour chacune :
-
Si c’est un mélange homogène ou hétérogène
-
Quels sont les constituants
1.
De l’eau sucrée obtenue en mélangeant du sucre dans de l’eau.
2.
Du sable mélangé à de l’eau.
3.
Un sirop de menthe versé dans un verre d’eau.
4.
Une vinaigrette (huile + vinaigre).
5.
Une limonade avec des bulles visibles.
Questions
:
a)
Classe les mélanges en deux colonnes : homogènes / hétérogènes.
b)
Explique pourquoi certains mélanges sont homogènes alors que d’autres sont
hétérogènes.
c)
Donne un exemple de mélange homogène utilisé dans la vie quotidienne.
EXERCICE
IV–
Identifier le type de mélange
Lis
les situations suivantes et réponds aux questions.
1.
Paul verse une cuillère de sel dans un verre d’eau et remue.
2.
Fatou met du lait dans son café.
3.
En classe, on mélange de la farine et de l’eau.
4.
Un élève secoue une bouteille contenant de l’huile et de l’eau.
5.
Une élève ouvre une bouteille de soda.
Questions
:
a)
Pour chaque situation, indique s’il s’agit d’un mélange homogène ou hétérogène.
b)
Donne la définition d’un mélange homogène et d’un mélange hétérogène.
c)
Propose un moyen simple de reconnaître un mélange hétérogène.
EXERCICE
V :
Température de changement d’état
On
réalise une expérience pour étudier la fusion de deux substances :
-
Tube A : contient de la glace pure.
-
Tube B : contient un mélange de glace et de sel.
Les
deux tubes sont chauffés lentement, et on note la température toutes les
minutes.
Temps
(min) | Température Tube A (°C) | Température Tube B (°C) |
|-------------|--------------------------|--------------------------|
|
0 | -5 | -10 |
|
1 | -2 | -8 |
|
2 | 0 | -5 |
|
3 | 0 | -2 |
|
4 | 0 | 0 |
|
5 | 0 | 2 |
Questions
:
1.
Quelle est la température de fusion de la glace pure ?
2.
Le mélange glace + sel fond-il à température constante ?
3.
Pourquoi la température du Tube B augmente progressivement pendant la fusion ?
4.
Peut-on parler de température de changement d’état pour un mélange ? Justifie
EXERCICE VI : Étude d’un mélange
eau + sucre
Un
élève prépare deux béchers identiques :
-
Bécher A contient uniquement de l’eau pure.
-
Bécher B contient de l’eau salée (mélange eau + sucre dissous).
Il
place les deux béchers au congélateur.
Il
mesure la température toutes les minutes pendant 20 minutes.
Tableau
des températures observées :
|
Temps (min) | Bécher A (°C) | Bécher B (°C) |
|-------------|---------------|----------------|
|
0 | 20 | 20 |
|
2 | 15 | 15 |
|
4 | 10 | 9 |
|
6 | 5 | 3 |
|
8 | 0 | -1 |
|
10 | 0 | -2 |
|
12 | 0 | -3 |
|
14 | 0 | -4 |
|
16 | 0 | -5 |
|
18 | 0 | -6 |
|
20 | -1 | -7 |
Questions
:
1.
Quelle est la température de solidification de l’eau pure ?
2.
Le mélange eau + sucre gèle-t-il à température constante ?
3.
Que peut-on dire de la température de changement d’état pour un mélange ?
4.
Pourquoi la température du Bécher B descend plus bas que celle de l’eau pure
EXERCICE
VII–
L’eau salée et la congélation
Une
scientifique remplit deux tubes à essai :
-
Tube A : contient de l’eau pure.
-
Tube B : contient un mélange d’eau + sel (eau salée).
Les
deux tubes sont placés dans un congélateur à –10 °C. Elle observe :
-
Le tube A commence à geler à 0 °C.
-
Le tube B reste liquide jusqu’à environ –5 °C.
Questions
:
1.
Quelle est la température de congélation de l’eau pure ?
2.
Quelle est l’influence du sel sur la température de congélation ?
3.
Peut-on dire que le mélange a une température de changement d’état fixe ?
Pourquoi ?
4.
Pourquoi met-on du sel sur les routes en hiver ?
CORRIGES
EXERCICE I :
1. Classement :
- A : Eau distillée → Corps pur (constituée uniquement
d’eau)
- B : Eau sucrée → Mélange (eau + sucre dissous)
- C : Alcool à 90% → Mélange (alcool + eau)
- D : Huile d’olive → Corps pur (même si c’est un mélange
naturel, en chimie on considère souvent comme corps pur car c’est une substance
homogène avec une composition constante)
- E : Jus de fruits industriel → Mélange (plusieurs
composants : eau, sucres, vitamines, etc.)
2. Explications :
- Un corps pur est constitué d’une seule substance chimique,
sans autre composant.
- Un mélange est composé de plusieurs substances mélangées
physiquement sans réaction chimique.
EXERCICE II :
a) Nature des échantillons :
1. Eau de mer : Mélange (dissolution de plusieurs sels dans
l'eau)
2. Glucose pur : Corps pur (substance chimique unique)
3. Air : Mélange (gaz composé de plusieurs gaz différents)
4. Lait entier : Mélange (suspension de plusieurs composants :
eau, lipides, protéines...)
5. Eau déminéralisée : Corps pur (eau pure, sans minéraux)
b) Explications :
- Un corps pur contient une seule substance chimique avec des
propriétés physiques constantes (point de fusion, ébullition précis).
- Un mélange contient plusieurs substances différentes
physiquement mélangées, souvent avec des propriétés variables.
EXERCICE III – Mélanges homogènes ou hétérogènes ?
| Situation | Type
de mélange | Constituants |
|------------------------------------- |--------------------- -|----------------------------------|
| 1. Eau sucrée |
Homogène | Eau + sucre (dissous) |
| 2. Sable + eau |
Hétérogène | Eau + sable |
| 3. Sirop de menthe dans l’eau | Homogène | Eau + sirop |
| 4. Vinaigrette (huile + vinaigre) | Hétérogène | Huile + vinaigre |
| 5. Limonade avec bulles | Hétérogène | Eau + sucre …
Réponses aux questions :
a) Classement :
- Mélanges homogènes : eau sucrée, sirop dans l’eau
- Mélanges hétérogènes : sable + eau, vinaigrette, limonade avec
bulles
b) Explication :
- Un mélange homogène a un aspect uniforme, on ne distingue pas
les constituants à l’œil nu.
- Un mélange hétérogène laisse apparaître plusieurs phases ou
éléments visibles.
c) Exemple :
- Le café au lait, le jus
d’orange filtré ou encore le vinaigre dilué dans de l’eau sont des mélanges
homogènes
EXERCICE IV : Identifier le type de mélange
1. Mélange homogène (le sel se dissout et la solution paraît
uniforme).
2. Mélange homogène (le lait se mélange complètement au café).
3. Mélange hétérogène (la farine ne se dissout pas complètement,
on voit des particules).
4.Mélange hétérogène (l’huile et l’eau ne se mélangent pas, on
voit deux phases distinctes).
5. Mélange homogène (le
gaz est dissous dans le liquide de façon uniforme).
b) Définitions :
- Mélange homogène : mélange dans lequel on ne peut pas
distinguer les différentes substances à l’œil nu, la composition est
uniforme.
- Mélange hétérogène : mélange dans lequel on peut distinguer
les différentes substances ou phases.
c) Moyen de reconnaître un mélange hétérogène :
Observer si l’on voit plusieurs phases ou différentes parties
visibles (par exemple : huile et eau séparées, particules non dissoutes).
EXERCICE V : Température de changement d’état
1. La température reste constante à 0 °C pendant plusieurs
minutes dans le Tube A.
Donc, la température de
fusion de la glace pure est 0 °C.
2. Non. Dans le Tube B,
la température augmente progressivement pendant la fusion (de -10 °C à 0 °C),
donc la fusion ne se fait pas à température constante.
Conclusion : un mélange
ne fond pas à température constante.
3. Parce qu’il s’agit
d’un mélange, et non d’un corps pur. Chaque composant fond à une température
différente, donc l’ensemble absorbe de l’énergie tout en changeant d’état sans
rester à température fixe.
4. Peut-on parler de température de changement d’état pour un
mélange ?
→ Non.
Contrairement à un corps pur qui change d’état à une température bien définie,
un mélange change d’état sur un intervalle de températures.
Donc, on ne peut pas
définir une température unique de changement d’état pour un mélange.
// Explication :
- Corps pur (ex : eau, fer, éthanol...) : il change d’état à une
température constante. Par exemple, l’eau pure bout à 100 °C à pression
normale.
- Mélange (ex : eau salée, huile + alcool...) : le changement
d’état se fait sur un intervalle de température, car les différents composants
n’ont pas le même point de fusion ou d’ébullition.
Exemple :
- L’eau salée bout au-dessus de 100 °C (dépend de la
concentration en sel).
- Un alliage métallique fond progressivement, sans température
fixe.
EXERCICE VI :
1. La température reste
constante à 0 °C entre 8 et 18 minutes. C’est la température de solidification
de l’eau pure.
2. Non. La température du
Bécher B continue de baisser pendant tout le refroidissement (de 20 °C à -7
°C). Il n’y a pas de plateau de température.
3.Pour un mélange, comme l’eau sucrée, le changement d’état ne
se fait pas à température constante. La température de solidification est plus
basse et varie au cours du temps.
4. La présence de sucre dans l’eau abaisse la température de
solidification. C’est un phénomène connu : les mélanges gèlent à une
température inférieure à celle du corps pur.
EXERCICE VII– L’eau salée et la congélation
1. La température de congélation de l’eau pure est 0 °C.
2. Le sel abaisse la température de congélation. L’eau salée
gèle à une température inférieure à 0 °C (ici environ –5 °C).
3. Non, un mélange (comme l’eau salée) n’a pas de température de
changement d’état fixe, car la présence du sel modifie progressivement le point
de congélation selon la quantité ajoutée.
4. Pour faire fondre la glace et empêcher l’eau de geler, car le
sel abaisse le point de congélation de l’eau. Cela rend les routes moins
glissantes et plus sûres