NOTION DE
POTENTIEL D’OXYDO-REDUCTION
CLASSIFICATION
QUANTITATIVE DES COUPLES OXYDANT-REDUCTEUR
Etude d’une pile Zinc-Cuivre : la pile Daniell
Réalisons le montage
suivant :
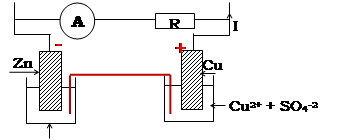
![]()
-Une lame de zinc
décapée plongeant dans une solution de sulfate de zinc (Zn2+ + SO2-4)
contenue dans un bécher constitue la demi-pile Zn2+/Zn
-Une lame de cuivre plongeant
dans une solution de sulfate de cuivre (Cu2+ + SO4-2)
contenue dans un second bécher, constitue la demi-pile Cu2+/Cu
Les deux
solutions sont reliées par un pont salin (constituée par exemple d’une
bande de papier filtré imbibée d’une solution concentrée de Nitrate d’ammonium)
dont le rôle est de maintenir le contact électrique entre les deux solutions.
Les deux lames
métalliques sont les électrodes de la pile. Lorsqu’on relie les deux électrodes
aux bornes d’un galvanomètre, il dévie, indiquant la présence d’un courant
circulant de l’électrode de cuivre à l’électrode de zinc
Le montage ainsi
réalisé constitue une pile dont l’électrode de cuivre est le pôle positif et
l’électrode de zinc, le pôle négatif. Les électrons sont fournis par
l’électrode de zinc (métal le plus réducteur).
La pile cuivre-zinc est la pile Daniell.
-
Au
pôle négatif : Zn →Zn2+
+ 2e
-
Au
pôle positif : Cu2+ + 2e→ Cu.
L’équation
–bilan de fonctionnement de la pile est :
Zn + Cu2+ → Zn2+ + Cu
Représentation :

Fem de
la pile :
La valeur indiquée par
le voltmètre est la tension à vide ou force électromotrice (fem) de la pile.
Si la concentration de la
solution est C= 1mol/l (solution molaire), la force électromotrice
est :
EZn-Cu
= Vcu – VZn = 1,10V
Remarque :
§ La concentration en ions
Cu2+ diminue dans la demi-pile Cu2+/Cu tandis que la masse de cuivre augmente.
§ La concentration en ions
Zn2+ augmente tandis que la masse de la lame de zinc diminue dans la demi-pile
Zn2+/Zn.
Etude des autres piles.
La pile cuivre-plomb
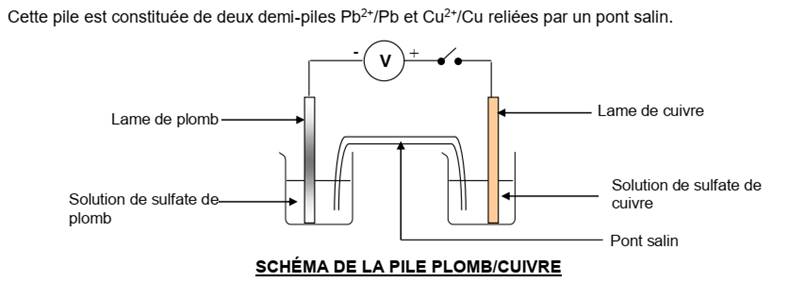
L’électrode de cuivre (métal
le moins réducteur) est le pôle positif de cette pile et l’électrode de plomb
(métal le plus réducteur), son pôle est négatif.

Equation-bilan:

Si C=
1mol/l
ECu-Pb = VCu
– VPb = 0,47V
La pile zinc-plomb
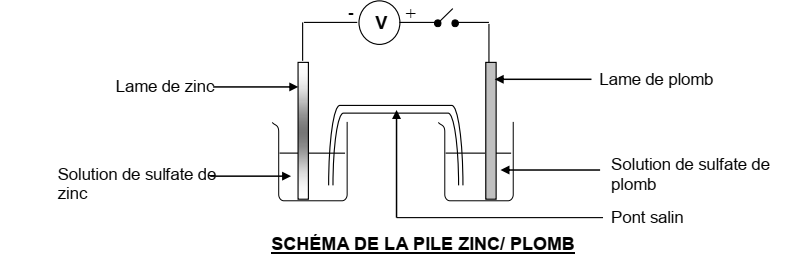
Le zinc est plus réducteur que le plomb. La lame de zinc constitue donc le pôle négatif et la lame de plomb le pôle positif

Equation-bilan:
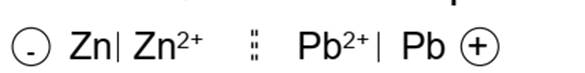
Si C=
1mol/l
EZn-Pb
= VZn – VPb = 0,63V
Généralisation
·
Une
demi-pile est une plaque de métal M plongeant dans une solution contenant les
ions métalliques Mn+.
·
Une
pile est un ensemble de deux demi-piles reliées par un pont salin.
·
Le
pôle négatif de la pile est constitué du métal le plus réducteur, le pôle
positif, du métal le moins réducteur.
·
Le
bilan de fonctionnement d’une pile est le même que celui de la réalisation
d’oxydoréduction spontanée entre les deux couples mis en jeu.
Classification quantitative des couples oxydant-réducteur
La
connaissance des valeurs des forces électromotrices (fem) des piles permet de
classer les couples oxydant-réducteur intervenant dans ces dernières. Soit à
placer le couple Pb2+/Pb par rapport aux couples Zn2+/Zn
et Cu2+/Cu.
EZn-Cu = Vcu
– VZn = 1,10V
EZn-Pb = VZn
– VPb = 0,63V
Plaçons ces couples
sur un axe gradué
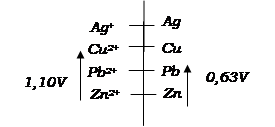
![]()
Réalisons une pile
constituée des deux demi- piles Pb2+/Pb et Cu2+/Cu et
mesurons sa fem. On trouve ECu-Pb
= VCu – VPb = 0,47V, ce qui correspond bien à
1,1-0,63.
On peut donc
écrire :
EZn-Cu=EZn-EPb
+ EPb-ECu
Ou VCu-Zn=
(VCu-VPb)+(VPb-VZn)
Potentiel d’oxydo-réducteur
L’électrode standard à hydrogène (ESH)
H2
![]() La demi-pile à hydrogène
est obtenue en faisant barboter du dihydrogène dans une solution d’acide pour
permettre le bon contact électronique et assurer le transfert des électrons,
l’oxydant et le réducteur du couple H3O+/H2
sont mis en présence par l’intermédiaire d’une électrode de platine
(inattaquable) présentant une grande surface de contact.
La demi-pile à hydrogène
est obtenue en faisant barboter du dihydrogène dans une solution d’acide pour
permettre le bon contact électronique et assurer le transfert des électrons,
l’oxydant et le réducteur du couple H3O+/H2
sont mis en présence par l’intermédiaire d’une électrode de platine
(inattaquable) présentant une grande surface de contact.
Par convention, lorsque
les conditions sont standards : pH=0,0 et P=1 bar.

Par convention, le
potentiel d’oxydo-réduction du couple H+/H2 ou (H3O+/H2),
noté E°(H+/H2) ou E°(H3O+/H2) nul à toute température.
En chimie, on l’utilise
comme électrode de référence à toute température
Potentiel d’oxydo-réducteur d’un couple Mn+/M
On détermine le
potentiel d’oxydo-réduction d’un couple cation métallique-métal Mn+/M
en réalisant la pile constante de l’électrode standard à hydrogène et la
demi-pile Mn+/M

NB: La fem est une ddp (différence de potentiel).
Si
la concentration [Mn+]= 1mol/l, le potentiel est dit standard et on
note E°(Mn+/M).
·
Le
potentiel d’oxydo-réduction d’un couple Mn+/M peut être positif. Le métal
M est moins réducteur que le dihydrogène. L’électrode constitue du métal M est
le pôle positif.
Exemple: (–) Pt│H3O+,H2⁞⁞Au3+
│Au (+) . E°(Cu2+/Cu) >0
·
Le
potentiel d’oxydo-réduction d’un couple Mn+/M peut aussi être
négatif. Le métal M est plus réducteur que le dihydrogène. L’électrode
constitue du métal M est le pôle négative.
Exemple:
(–) Zn│Zn2+⁞⁞H2,H3O+
│Pt (+) E°(Zn2+/Zn)
<0

Demi-pile de référence secondaire
La
réalisation de l’ESH est délicate. On la substitue très souvent par une
demi-pile plus facile à réaliser, à l’exemple de la demi-pile au Cuivre :
c’est une demi-pile de référence secondaire
La fem de la pile est
obtenue en associant cette demi-pile à une demi-pile Mn+/M.
VM –
VCu =(VM – VESH)+(VESH – VCu)
=E°(Mn+/M) - E°(Cu2+/Cu)
Le potentiel standard est donc
E°(Mn+/M) = VM–VCu +
E°(Cu2+/Cu) = VM – VCu
+0,34 V
Utilisation de la classification
électrochimique
Force des oxydants et des réducteurs
Un
oxydant est d’autant plus fort que le couple auquel il appartient à un
potentiel d’oxydo-réduction élevé. Un réducteur est d’autant plus fort que le
couple auquel il appartient à un potentiel d’ox/red faible.
Prévision des réactions
La
réaction naturelle entre deux couples est celle qui fait intervenir l’oxydant
du couple du plus haut potentiel avec le réducteur du couple de plus bas
potentiel.
Détermination de la polarité et de la fem de la pile
Considérons
une pile réalisée à partir de deux couples M1n1+/M1
et M2n2+/M2 choisis tel que :
E°(M1n1+/M2)
> E° (M2n2+/M2)
EM2 – M1
= VM1 - M2 = (VM1 – VESH) + (VESH
- VM2)
= E°(M1n1+/M1)
- E° (M2n2+/M2).
La fem d’une pile est égale à la ddp entre le
potentiel oxydoréduction du couple intervenant au pôle positif et le potentiel
oxydoréduction intervenant au pôle négatif.
EXERCICES
EXERCICE I :
1-On associe une demi
-pile standard au zinc à une demi-pile standard au cuivre. La fem de la pile
ainsi constituée est égale à 1,10V. L’électrode de cuivre en constitue le pôle
positif. En déduire la valeur du potentiel
redox standard du couple Zn++/Zn connaissant le potentiel
redox standard du couple Cu++/Cu
E°( Cu++/Cu)=0,34 V.
2-On réalise une pile en associant une
demi-pile standard au cuivre et une demi-pile standard au fer.
2.1-A
l’aide de la classification quantitative
des couples, déterminer la polarité de cette pile sa fem et son schéma
conventionnel.
2.2-En
déduire les équations de réactions qui se déroulent aux électrodes au cours de
son fonctionnement.
EXERCICE II :
On
associe une demi-pile Au3+/Au
constitué par un fil d‘or plongeant dans une solution de chlorure d’or III (Au3+
+ 3Cl-) à 0,40mol/l, à une demi-pile standard à hydrogène.
L’électrode de platine constitue le pôle négatif de cette pile. Sa fem vaut E
(ESH, Au)=1,44V
1-Donner
le schéma conventionnel de cette pile.
2-Quelles
sont les réactions qui se passent aux électrodes lorsque cette pile débite un
courant ?
En
déduire l’équation bilan de fonctionnement de cette pile
3-Quelle
est la valeur du potentiel redox du couple Au3+/Au ? Que
peut-on dire du pouvoir oxydant des ions Au3+
EXERCICE
III : On réalise une pile argent-nickel en associant une lame de
nickel Ni plongeant dans une solution de sulfate de nickel (Ni2+ +
SO42-) à une lame d’argent plongeant dans une solution de
nitrate d’argent (Ag+ +NO3-). Les potentiels des couples
sont : E°(Ag+/Ag)=0,80V ;E°(Ni2+/Ni)=-0,27V.
.1-
Donner la représentation conventionnelle de cette pile. Préciser sa polarité.
Calculer la force électromotrice de cette pile.
2-
Ecrire l’équation-bilan de fonctionnement de cette réaction en précisant les
demi-équations à chaque électrode lorsque la pile débite.
3-
Calculer la variation de masse de l’électrode constituant le pôle négatif de la
pile lorsqu’elle débite une courante intensité constante I=10mA pendant 3
heures.
EXERCICE IV :
Le
bilan de fonctionnement d’une pile fer-argent est :
Fe
+ 2Ag+ →Fe2+ +2Ag
1-Faire
le montage correspondant. Quel est le pôle négatif de cette pile ?
2-Pendant
son fonctionnement, la masse de l’électrode de fer a diminué de 50 mg. Quelle
est la quantité d’électricité débitée par cette pile ?
3-Déterminer
la variation de la masse correspondante à l’électrode d’argent ?
On
donne 1F=96500C
EXERCICE V:
On
donne les potentiels normaux
°(Ag+/Ag)=0,80 ;E°(Au3+/Au)=1,50V
On réalise la pile théorique :
![]() Ag │Ag+⁞⁞Au3+│Au
Ag │Ag+⁞⁞Au3+│Au![]()
Quelle
est sa polarité ? Sa fem ? les réactions aux électrodes et
l’équation-bilan de la réaction qui s’effectue dans la pile lorsqu’elle débite.
3-On laisse la pile
fonctionne pendant 3 heures et on constate que la masse de l’électrode en or a
augmenté de 98,5mg. Calculer :
-
La
diminution de la masse d’électrode d’argent.
-
L’intensité
du courant, supposé constant, supposé constante, qui a circulé.
CORRIGES
EXERCICE
I :
1-
E°( Cu++/Cu)=0,34
V.
Le cuivre
constitue le pôle positif (métal moins réducteur)
Ezn-cu
=E°(Cu++/Cu) –E°(Zn++/Zn)
=> E°(Zn++/Zn)= E°(Cu++/Cu)
- EZn-Cu
=0,34-1,1=-0,76 V.
2-
2.1-
E°( Cu++/Cu)=0,34 V > E°( Fe++/Fe)=-0,44 V.
donc le cuivre constitue le pôle positif et le fer le pôle négatif.
EFe-Cu
= E°( Cu++/Cu) – E°(Fe++/Fe)=0,34-(-0,44)=0,78V.
(–) Fe│Fe2+⁞⁞Cu2+│Cu
(+)
2.2-
Anode :Fe → Fe2+ +2e
Cathode : Cu2+ +2e →
Cu
Bilan :Fe + Cu2+→Fe2+ +Cu
EXERCICE
II :
1- Schéma
conventionnel de cette pile.
(–) Pt│H3O+,H2⁞⁞Au3+
│Au (+)
2-Anode : H2 +2H2O→2H3O+
+ 2e
Cathode : Au3+ +3e →Au
Bilan :3H2 +6H2O +2 Au3+→6H3O+
+2Au
3-
EESH-Au=E°( Au3+/Au ) - E°( ESH )
Or E°( ESH )=E°(H3O+/H2)=0
E°( Au3+/Au ) = EESH-Au=1,44V
Les ions Au3+ sont des oxydants plus forts que les
ions H3O+
car E°( Au3+/Au )> E°(H3O+/H2)
EXERCICE III :
.1-Représentation
conventionnelle de cette pile.
(–) Ni│Ni2+⁞⁞Ag+│Ag
(+)
ENi-Ag=
E°( A+/Ag) – E°(Ni2+/Ni)=0,80-(-0,23)=1,03V
2-Equation-bilan de fonctionnement de
cette réaction en précisant les demi-équations à chaque électrode lorsque la
pile débite.
Ni+2Ag+→Ni2+
+2Ag
3-Variation de masse de l’électrode constituant le pôle négatif.
n=Q/xF avec Q=It //voir la loi de Faraday (cours)
![]() =
=![]()
![]()
![]() .
.
EXERCICE
IV :
1-Le pôle négatif de cette pile est constitué par le couple (Fe++/Fe)
car il y a oxydation du fer.
2- Quantité d’électricité débitée par cette pile
Fe →Fe2+ +2e
n=Q/xF
=>Q=xF n(Fe) =2Fm(Fe)/M(Fe)= 2x96500x0,05/56
=172,32 C
3- Variation de la masse correspondante à l’électrode d’argent
Fe + 2Ag+ →Fe2+
+2Ag
1mol
2mol
n(Fe)=n(Ag)/2 =>n(Ag) =2n(Fe)
![]() =>
=>
![]()
=2x8,9310-3 x108=33,24 g.
EXERCICE V:
On réalise la pile
théorique :
![]() Ag │Ag+⁞⁞Au3+│Au
Ag │Ag+⁞⁞Au3+│Au![]()
polarité
Pôle négatif : Ag+ /Ag
Pôle positif : Au3+ /Au
fem
EAg-Au =E°( Au3+ /Au)-E°( Ag+
/Ag)=1,50-0,80=0,70V
Réactions aux électrodes
Anode : Ag → Ag+ + e
Cathode : Au3+ + 3 e → Au
équation-bilan
3Ag +Au+++ →3Ag+ + Au
3- Diminution
de la masse d’électrode d’argent.
3Ag +Au3+
→3Ag+ + Au
3mol 1 mol.
3 mol. 1mol
![]()
![]()
=>![]()
-
intensité du
courant
![]() //voir
la loi de Faraday(cours)
//voir
la loi de Faraday(cours)
![]() =
=![]() .
.
or Q=It donc
It=n(Ag)F =>I=n(Ag)F/t=0015.96500/3.3600 = 0,0134 A.
Avez-vous
un exercice a proposer?Cliquez-ici
Merci de votre visite
Laissez un commentaire